题目内容
【题目】根据部分短周期元素的信息回答问题。
元素 | 元素信息 |
| 第3周期ⅥA族 |
| 族序数是周期数的3倍 |
| 原子序数是11 |
|
|
(1)![]() 、
、![]() 的元素符号分别为______、______,
的元素符号分别为______、______,![]() 、
、![]() 的元素名称分别为______、______。
的元素名称分别为______、______。
(2)写出![]() 、
、![]() 的常见单质在加热时的反应方程式:______。
的常见单质在加热时的反应方程式:______。
(3)从原子结构的角度分析,![]() 原子与
原子与![]() 原子的______相同,
原子的______相同,![]() 原子与
原子与![]() 原子的______相同。
原子的______相同。
【答案】![]()
![]() 钠 铝
钠 铝 ![]() 最外层电子数 电子层数
最外层电子数 电子层数
【解析】
短周期是第1、2、3周期,由周期序数=电子层数、主族序数=最外层电子数、原子序数=核电荷数=核外电子数等,可推出A是硫,B是氧,C是钠。根据D3+与Ne的电子数相同,可得出D为铝。钠与氧气在加热时反应生成过氧化钠。
(1)根据分析,![]() 、
、![]() 的元素符号分别为S、O,
的元素符号分别为S、O,![]() 、
、![]() 的元素名称分别为钠、铝;
的元素名称分别为钠、铝;
(2) B是氧,C是钠, ![]() 、
、![]() 的常见单质在加热时的反应方程式:2Na+O2
的常见单质在加热时的反应方程式:2Na+O2![]() Na2O2;
Na2O2;
(3)从原子结构的角度分析,![]() 原子与
原子与![]() 原子是同主族元素,同主族元素最外层电子数目相同;
原子是同主族元素,同主族元素最外层电子数目相同;![]() 原子与
原子与![]() 原子是同周期元素,同周期元素电子层数相同。
原子是同周期元素,同周期元素电子层数相同。

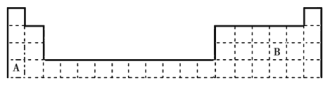
【题目】Ⅰ.下表是元素周期表的一部分, 回答下列问题:
a | ||||||||
b | c | d | e | |||||
f | g | h | i |
(1)d、e、f对应简单离子的半径由大到小的顺序为_______(用具体微粒符号表示)。
(2)元素i的单质溶于水,生成一种具有漂白作用的化合物,该化合物的电子式为_____;写出a与c形成的一种含18电子且既含极性键又含非极性键的化合物的分子式_________。
(3)以元素a的单质为燃料,以f的最高价氧化物对应的水化物为电解质溶液,请写出该燃料电池的负极反应方程式_________。
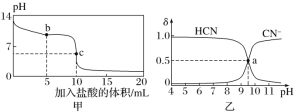
Ⅱ. (1)根据下列信息判断氢气燃烧生成水时的热量变化:
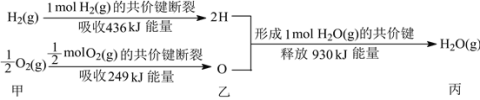
①H2(g)与O2(g)反应生成1molH2O(g)时放出的热量为________kJ;
②图中甲、乙、丙中物质所具有的总能量由大到小顺序为:________;
(2)铅蓄电池是最常见的二次电池,放电时的化学方程式为:Pb(s) + PbO2(s) + 2H2SO4(aq) = 2PbSO4(s) + 2H2O。负极反应式为__________,一段时间后,负极增重48克,转移电子_______mol。
【题目】某化学兴趣小组对加碘食盐中碘酸钾进行研究,查阅资料得知:碘酸钾是一种白色粉末,常温下很稳定,加热至560℃开始分解。在酸性条件下碘酸钾是一种较强的氧化剂与HI、H2O2等物质作用,被还原为单质碘。
(1)学生甲设计实验测出加碘食盐中碘元素的含量,步骤如下:
①称取wg加碘盐,加适量蒸馏水溶解。
②用稀硫酸酸化所得的溶液,再加入过量KI溶液,写出该步反应的离子方程式:_______。
③以淀粉为指示剂,用物质的量浓度为1.00×10-3molL-1的Na2S2O3溶液滴定![]() 滴定时的反应方程式为
滴定时的反应方程式为![]() ,滴定时Na2S2O3溶液应放在 ______
,滴定时Na2S2O3溶液应放在 ______ ![]() 填“酸式滴定管”或“碱式滴定管”
填“酸式滴定管”或“碱式滴定管”![]() ,滴定至终点的现象为_______________。
,滴定至终点的现象为_______________。
(2)学生乙对纯净的NaCl(不含KIO3)进行了下列实验:
顺序 | 步骤 | 实验现象 |
① | 取少量纯净的NaCl,加适量蒸馏水溶解 | 溶液无变化 |
② | 滴入少量淀粉-KI溶液,振荡 | 溶液无变化 |
③ | 然后再滴加稀硫酸,振荡 | 溶液变蓝色 |
请推测实验③中产生蓝色现象的可能原因: __________________ ;根据学生乙的实验结果可推测学生甲的实验结果可能 ______ (填“偏大”、“偏小”或“无影响”)。
(3)学生丙设计实验证明加碘食盐样品中碘元素的存在形式是IO3-而不是I-,进行如下实验。写出实验步骤、预期现象和结论。限选试剂:稀硫酸、稀硝酸、3% H2O2溶液、新制氯水、1%淀粉溶液、蒸馏水。
实验步骤 | 预期现象和结论 |
步骤1:取少量食盐样品于试管中,加适量蒸馏水使其完全溶解, _____________________ | ______ |
步骤2:另取少量食盐样品于试管中,加适量蒸馏水使其完全溶解,滴入适量的稀硫酸酸化, _____________________ | ______ |