题目内容
【题目】天然气、可燃冰、页岩气、沼气的主要成分都是甲烷,甲烷既是一种清洁能源,也是一种重要的化工原料。
(1)以甲烷为主要原料可生产合成气(CO和H2)。
已知:①CH4(g)+2O2(g)===CO2(g)+2H2O(g)
ΔH=-802.3 kJ·mol-1
②CO(g)+H2O(g) ![]() CO2(g)+H2(g)
CO2(g)+H2(g)
ΔH=-41.0 kJ·mol-1
③2CO(g)+O2(g)===2CO2(g)
ΔH=-566.0 kJ·mol-1
则反应CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)的ΔH=__________________。
2CO(g)+2H2(g)的ΔH=__________________。
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸,反应方程式为CO2(g)+CH4(g) ![]() CH3COOH(g)。
CH3COOH(g)。
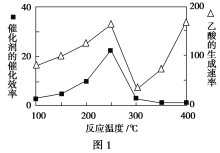
①在不同温度下催化剂的催化效率与乙酸的生成速率如图1所示。250~300 ℃时,温度升高而乙酸的生成速率降低的原因是_________________________。
②为了提高该反应中CH4的转化率,可以采取的措施是______________________(写出一条即可)。
(3)甲烷燃料电池是一种新型电池。如图2所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ可实现铁棒上镀铜。
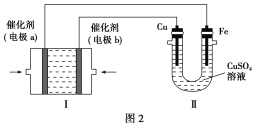
①电极b上的电极反应式是______________________。
②电镀结束后,装置Ⅰ中溶液的pH________(填“变大”、“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度______________。
③若完全反应后,装置Ⅱ中阴极质量增加12.8 g,则装置Ⅰ中理论上消耗的氧气在标准状况下的体积为________L。
【答案】(1)+247.7 kJ·mol-1
(2)①温度超过250 ℃时,催化剂的催化效率降低 ②缩小容器体积(增大压强)或增大CO2的浓度(答出一条即可)
(3)①O2+2H2O+4e-===4OH- ②变小 不变 ③2.24
【解析】(1)根据盖斯定律,将①+②×2-③×2得目标方程式,其ΔH=(-802.3-41.0×2+566.0×2) kJ·mol-1=+247.7 kJ·mol-1。
(2)①温度超过250 ℃时,催化剂的催化效率降低,导致反应速率降低。②CO2(g)+CH4(g) ![]() CH3COOH(g)是气体物质的量减少的反应,缩小容器体积(增大压强),平衡正向移动,CH4的转化率增大。增大CO2的浓度也可使平衡正向移动,提高CH4的转化率。
CH3COOH(g)是气体物质的量减少的反应,缩小容器体积(增大压强),平衡正向移动,CH4的转化率增大。增大CO2的浓度也可使平衡正向移动,提高CH4的转化率。
(3)①在铁棒上镀铜时,铜棒是阳极,铁棒是阴极,与铜棒相连的电极是电源的正极,与铁棒相连的电极是电源的负极,故a为负极,通入甲烷,b为正极,通入氧气,氧气在碱性条件下得电子生成OH-。②该甲烷燃料电池的总反应为CH4+2O2+2KOH===K2CO3+3H2O,故电镀结束后,装置Ⅰ中溶液的pH减小;电镀池中,阳极铜溶解,阴极析出铜,溶液中Cu2+的物质的量浓度不变。③装置Ⅱ中阴极增加的质量是Cu的质量,n(Cu)=0.2 mol,则反应中转移0.4 mol电子,根据电子得失守恒,可知理论上应消耗0.1 mol O2,在标准状况下的体积为2.24 L。

 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案