题目内容
【题目】(1)已知:2SO2(g)+O2(g)2SO3(g)△H=-196.6kJmol-1
2NO(g)+O2(g)2NO2(g)△H=-113.0kJmol-1
则反应NO2(g)+SO2(g)SO3(g)+NO(g)的△H=______kJmol-1.
(2)一定条件下,将NO2与SO2以物质的量比为1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是______。[不考虑N2O4(g)![]() 2NO2(g)的转化]
2NO2(g)的转化]
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1mol SO3的同时生成1mol NO2
(3)测得上述反应平衡时NO2与SO2物质的量比为1:6,则平衡时SO2的转化率为___________。
【答案】 -41.8 kJmol-1 b 40%
【解析】试题分析: (1)根据盖斯定律,NO2(g)+SO2(g)SO3(g)+NO(g)的焓变;(2)根据化学平衡平衡的定义判断状态;(3)根据“三段式”计算,平衡时SO2的转化率。
解析:(1)Ⅰ、 2SO2(g)+O2(g)2SO3(g)△H=-196.6kJmol-1;
Ⅱ、2NO(g)+O2(g)2NO2(g)△H=-113.0kJmol-1,根据盖斯定律Ⅰ÷2-Ⅱ÷2得NO2(g)+SO2(g)SO3(g)+NO(g) △H=-41.8 kJmol-1;
(2)a.反应前后气体物质的量不变,所以体系压强保持不变,不一定平衡,故a错误; b.NO2是红棕色气体,混合气体颜色保持不变,说明NO2浓度不变,反应一定平衡,故b正确;c.SO3和NO是的生成物,SO3和NO的体积比是定值,SO3和NO的体积比保持不变不一定平衡,故c错误; d.每消耗1molSO3的同时生成1molNO2,都是逆反应方向,不一定平衡,故d错误;
(3)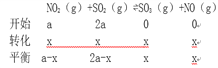
![]()
![]() , 平衡时SO2的转化率为
, 平衡时SO2的转化率为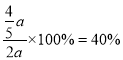 。
。