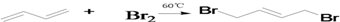题目内容
2.将0.1mol有机化合物A与标准状况下5.6L氧气混合,一定条件下两者完全反应,只有CO、CO2和H2O三种产物,将全部产物依次通入足量的浓硫酸和碱石灰中,浓硫酸增重5.4克,碱石灰增重4.4克,还有标准状况下2.24L气体的剩余,求:(1)有机化合物A的分子式(要求写出推理过程);
(2)若有机化合物A能与钠反应放出氢气,请写出A的结构简式.
分析 根据浓硫酸的增重可以判断出生成水的物质的量,可知0.1mol该有机物中含有的氢原子的物质的量;根据碱石灰增重可以知道0.1mol有机物中燃烧生成二氧化碳中的C的物质的量;根据2.24L剩余气体为CO,可知CO中碳的物质的量,两者之和是0.1mol有机物中碳的物质的量,标况下与5.6L氧气完全反应,根据反应产物中的氧原子与氧气的氧原子的物质的量关系确定该有机物分子中是否含有氧原子,并计算出0.1mol该有机物中含有的氧原子的物质的量,最后计算出该有机物的分子式,然后据此分析.
解答 解:(1)标况下5,6L氧气的物质的量为:n(O2)=$\frac{5.6L}{22.4L/mol}$=0.25mol,n(O)=0.25mol×2=0.5mol,
浓硫酸增重的为水的质量,5.4gH2O的物质的量为:$\frac{5.4g}{18g/mol}$=0.3mol;
其中的n(H)=0.3mol×2=0.6mol,n(O)=0.3mol,
有机物燃烧生成的二氧化碳的物质的量为:$\frac{4.4g}{44g/mol}$=0.1mol,其中的n(C)=0.1mol,n(O)=0.2mol,
有机物燃烧生成的一氧化碳的物质的量为:$\frac{2.24L}{22.4L/mol}$=0.1mol,其中的n(C)=0.1mol,n(O)=0.1mol,
其中的n(H)=0.3mol×2=0.6mol,n(O)=0.3mol,
可知0.1mol有机物含0.2mol碳原子、0.6mol氢原子;有机物含氧原子的物质的量为:n(H2O)+n(CO)+2n(CO2)-n(O)=0.3mol+0.1mol+0.2mol-0.5mol=0.1mol,
所以n(有机):n(C):n(H):n(O)=0.1:0.2:0.6:0.1=1:2:6:1,
答:该有机物分子式为C2H6O;
(2)若有机化合物A能与钠反应放出氢气,则分子中含有羟基,则A的结构简式为C2H5OH或CH3CH2OH,
答:A的结构简式为C2H5OH或CH3CH2OH.
点评 本题考查有机物分子式确定、有机物结构的判断、有机物燃烧计算等,侧重于学生的分析、计算能力的考查,难度不大,注意理解掌握燃烧法利用原子守恒确定有机物的组成.

 名校课堂系列答案
名校课堂系列答案| A. | 向该溶液中滴加几滴浓盐酸,平衡逆向移动,c(H+)减小 | |
| B. | 向该溶液中加入少量CH3COONa固体,平衡正向移动 | |
| C. | 该温度下0.01mol/L醋酸溶液Ka<1.75×10-5 | |
| D. | 升高温度,c(H+)增大,Ka变大 |
| A. | 气体分子间的平均距离 | B. | 气体的分子的形状 | ||
| C. | 气体分子本身的大小 | D. | 气体分子的种类 |
| A. | 酸性高锰酸钾溶液 | B. | 溴水 | ||
| C. | Na2CO3溶液 | D. | NaOH溶液 |
| A. | 纯银饰品久置表面变暗属于化学腐蚀 | |
| B. | 温度越高,金属发生化学腐蚀的速率越快 | |
| C. | 金属腐蚀就是金属失去电子被氧化的过程 | |
| D. | 铁门上的铜铆钉处在潮湿的空气中直接发生反应:Fe-3e-═Fe3+ |