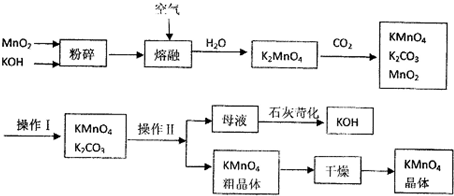
题目内容
3.下列说法正确的是A(s)+B(g)═C(g)+D(g)△H>0,下列说法正确的是( )| A. | 该反应过程中体系的混乱度减小 | |
| B. | 由于△H>0,△S>0,可知该反应的条件为高温 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 在任何条件下△H-T△S都可作为化学反应方向的判据 |
分析 A、根据反应前后气体的量的变化确定反应的熵变;
B、根据反应自发进行的判据来回答;
C、根据焓变符号来确定反应是吸热还是放热;
D、反应的自发性是指没有外界干扰式体系的性质.
解答 解:A、该反应后气体的量增大,则反应的混乱度增大,故A错误;
B、该反应△H>0,△S>0,代入反应能自发进行的判据:△H-T△S<0,所以高温能自发进行,故B正确;
C、焓变△H>0,确定该反应是吸热反应,则反应物的总能量低于生成物的总能量,故C错误;
D、反应的自发性是指没有外界干扰式体系的性质,故D错误.
故选B.
点评 本题考查学生判断反应能否自发进行的方法以及判断反应焓变和熵变的方法,可以根据所学知识进行回答,难度不大.

练习册系列答案
相关题目
11.把温度为20℃,浓度为1.0mol•L-1的H2SO4和2.2mol•L-1的碱溶液各50mL混合(溶液密度均为1g•mL-1,比热容为4.184kJ•K-1•kg-1)轻轻搅动,测得酸碱混合液的温度变化数据如下:
则反应NH3•H2O?NH${\;}_{4}^{+}$+OH-的焓变约为(单位:kJ•mol-1)( )
| 反应物 | 起始温度t1℃ | 终止温度t2℃ |
| H2SO4+NaOH | 20 | 33.6 |
| H2SO4+NH3•H2O | 20 | 32.6 |
| A. | 2.1 | B. | 4.2 | ||
| C. | 52.7 | D. | 缺少数据无法计算 |
18.实验室准备制HCl气体,在反应前有下面的操作:①烧瓶里放人食盐,分液漏斗盛入浓硫酸;②把酒精灯放在铁架台上;③将烧瓶夹在铁夹上;④放上铁圈和石棉网;⑤将带分液漏斗和导管的橡皮塞到烧瓶口上;⑥检查仪器装置的气密性.正确操作的先后顺序是( )
| A. | ①⑥②③④⑤ | B. | ①⑤⑥②③④ | C. | ⑥②③④①⑤ | D. | ②④③⑤⑥① |
8.某有机物的结构简式如图此有机物的说法不正确的是( )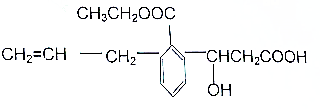

| A. | 可发生的反应类型有:取代、加成、消去、酯化、水解、氧化、中和、聚合 | |
| B. | 1mol该物质与足量NaOH溶液反应,消耗NaOH的物质的量为2mol | |
| C. | 1mol该物质与Na、Na2CO3、NaHCO3反应时,所消耗的物质的量之比为2:1:2,产生的气体在标准状况下的体积比是2:1:2 | |
| D. | 该有机物属于芳香族化合物 |
3.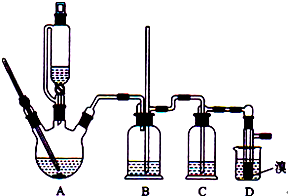 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH→CH2=CH2+H2O
CH2=CH2+Br2→BrCH2CH2Br
可能存在的副反应有:乙醇在浓硫酸的存在下l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷,装置如图所示:有关数据列表如下:
回答下列问题:
(1)在此制备实验中,要尽可能快地把反应温度升高到170℃左右,其目的有ad(填正确选项前的字母)
a.引发反应
b.加快反应速度
c.防止乙醇挥发
d.减少副产物乙醚生成
(2)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”)
(3)实验过程中装置B可以防止倒吸,并检查装置C、D是否堵塞,写出装置D堵塞时B中的现象当装置发生堵塞时,B装置中液体会压入的长玻璃导管,甚至溢出导管,以观测和缓解气压增大
(4)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去
(5)反应过程中应用冷水冷却装置D,其主要目的是冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是产品1,2-二溴乙烷的熔点(凝固点)低,过度冷却会凝固而堵塞导管.
 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH→CH2=CH2+H2O
CH2=CH2+Br2→BrCH2CH2Br
可能存在的副反应有:乙醇在浓硫酸的存在下l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷,装置如图所示:有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在此制备实验中,要尽可能快地把反应温度升高到170℃左右,其目的有ad(填正确选项前的字母)
a.引发反应
b.加快反应速度
c.防止乙醇挥发
d.减少副产物乙醚生成
(2)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”)
(3)实验过程中装置B可以防止倒吸,并检查装置C、D是否堵塞,写出装置D堵塞时B中的现象当装置发生堵塞时,B装置中液体会压入的长玻璃导管,甚至溢出导管,以观测和缓解气压增大
(4)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去
(5)反应过程中应用冷水冷却装置D,其主要目的是冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是产品1,2-二溴乙烷的熔点(凝固点)低,过度冷却会凝固而堵塞导管.
4.下列说法错误的是( )
| A. | 浓盐酸易挥发,盛在无色密封的玻璃瓶中 | |
| B. | 久置浓硝酸呈黄色,消除黄色的方法是向溶液中加水 | |
| C. | 除去C02中混有的S02:用饱和NaHC03溶液洗气,再干燥 | |
| D. | 液溴易挥发,盛放在用水密封的用玻璃塞塞紧的棕色试剂瓶中 |
 一定温度下体积为5L的密闭容器中发生可逆反应.
一定温度下体积为5L的密闭容器中发生可逆反应.