题目内容
6.工业合成甲醇的一种途径中,各物质间的转化关系如图1.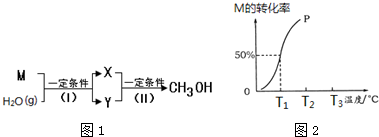
(1)已知M是含有10个电子的分子,X为单质、Y为化合物,均是还原性的气体.反应(I)的化学方程式为CH4+H2O$\stackrel{一定条件下}{→}$CO+3H2.
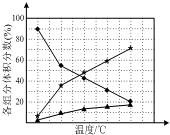
(2)将2.0molM和2.0mol H2O ( g )通入1L的密闭容器中,发生反应(I),测得在一定的压强下反应(I)达到平衡M的转化率与温度的关系如图2.
①假设T1℃时达到平衡所需的时间为5min,则用H2O ( g )表示该反应的平均反应速率为0.2.
②反应(I)的平衡常数表达式为K=$\frac{c(CO)•c{\;}^{3}(H{\;}_{2})}{c(CH{\;}_{4})•c(H{\;}_{2}O)}$.
③反应(I)的△H>0(填“>”或“<”)
(3)关于反应(I)判断正确的是AB
A.增加H2O(g)的量,M的转化率升高而H2O(g)的转化率降低
B.若M与H2O(g)的转化率相同时,二者的初始投入量一定相同
C.M和H2O(g)初始物质的量之比等于二者转化率之比
(4)该温度下,向容器中充入1molM、3mol H2O、2mol X、1molY,则起始时该反应速率 V正>V逆(填“>”、“<”或“=”)
分析 (1)根据转化关系图和元素守恒可知M含有碳元素,已知M是含有10个电子的分子,X为单质、Y为化合物,均是还原性的气体,则M为CH4,X为H2,Y为CO;
(2)①利用三段式求出转化的H2O的物质的量,再求出其反应速率;
②平衡常数为:K=$\frac{c(CO)•c{\;}^{3}(H{\;}_{2})}{c(CH{\;}_{4})•c(H{\;}_{2}O)}$;
③根据图象可知温度越高,甲烷的转化率越大,依此判断;
(3)A、通过表中的数据即可得出结论;
B、根据转化率=$\frac{△n}{n}$来分析;
C、CO和H2O(g)的转化率之比等于计量数之比;
(4)计算出此温度下的平衡常数K的数值,与浓度商Qc作比较,即得出V正和V逆的大小关系.
解答 解:(1)根据转化关系图和元素守恒可知M含有碳元素,已知M是含有10个电子的分子,所以M为CH4,X为单质、Y为化合物,均是还原性的气体,则X为H2,Y为CO,所以反应的化学方程式为:CH4+H2O$\stackrel{一定条件下}{→}$CO+3H2;
故答案为:CH4+H2O$\stackrel{一定条件下}{→}$CO+3H2;
(2)①设参加反应的甲烷的物质的量为xmol,
CH4+H2O$\stackrel{一定条件下}{→}$CO+3H2
起始量(mol):2 2 0 0
转化量(mol):x x x 3x
平衡量(mol):2-x 2-x x 3x
已知平衡时CH4的转化率为50%,则 $\frac{x}{2}$×100%=50%,所以x=1,△c(H2O)=1mol/L,v(H2O)=$\frac{△c}{t}$=$\frac{1mol/L}{5min}$=0.2mol•L-1•min-1;
故答案为:0.2;
②平衡常数为:K=$\frac{c(CO)•c{\;}^{3}(H{\;}_{2})}{c(CH{\;}_{4})•c(H{\;}_{2}O)}$;故答案为:K=$\frac{c(CO)•c{\;}^{3}(H{\;}_{2})}{c(CH{\;}_{4})•c(H{\;}_{2}O)}$;c
③根据图象可知温度越高,甲烷的转化率越大,说明升高温度平衡向正方向移动,所以正方向为吸热反应,即△H>0;
故答案为:>;
(3)①A、从表中数据可知增加H2O(g)的量,CO的转化率升高而H2O(g)的转化率降低,故A正确;
B、物质的转化率=$\frac{△n}{n}$,而根据反应可知:△n(CO):△n(H2O)=计量数之比=1:1,故若CO与H2O(g)的转化率相同时,二者的初始投入量一定相同,B正确;
C、CO和H2O(g)的转化率之比等于计量数之比,与初始物质的量成反比,故C错误;
故选:AB;
(4)化学平衡常数K=$\frac{c(CO)•c{\;}^{3}(H{\;}_{2})}{c(CH{\;}_{4})•c(H{\;}_{2}O)}$=$\frac{1×3{\;}^{3}}{1×1}$=27,在该温度下,向容器中充入1molM、3mol H2O、2mol X、1molY时,浓度商Qc=$\frac{2{\;}^{3}×1}{1×3}$=$\frac{8}{3}$<K,则平衡向正反应方向移动,故V正>V逆,
故答案为:>.
点评 本题考查了物质的推断、方程式的书写、化学平衡的有关计算、平衡常数、反应热的计算等,涉及的知识点较多,题目难度较大,侧重对基本知识的应用的考查,以及对学生综合能力的考查.

 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案| A. | 该电池工作时,正极反应为:2AgCl+2e-═2Cl-+2Ag | |
| B. | 镁电极作该电池负极,负极反应为:Mg-2e-═Mg2+ | |
| C. | 当有24g Mg被氧化时,有108 g AgCl被还原 | |
| D. | 装备该电池的鱼雷在水中行进时,海水作为电解质溶液 |
| ① | He-268.8 | (a)-249.5 | Ar-185.8 | Kr-151.7 |
| ② | F2-187.0 | Cl2-33.6 | (b) 58.7 | I2 184.0 |
| ③ | (c) 19.4 | HCl-84.0 | HBr-67.0 | HI-35.3 |
| ④ | H2O 100.0 | H2S-60.0 | (d)-42.0 | H2Te-1.8 |
| A. | 系列①的(a)物质中没有离子键,应有共价键和分子间作用力 | |
| B. | 系列③中(c)物质的沸点比HCl高是因为(c)中的共价键更牢固 | |
| C. | 系列②中(b)物质的元素的原子序数应为35,且该物质常温下为液态 | |
| D. | 系列④中H2O沸点变化出现反常,是因为分子内有氢键的影响 |
| A. | 除去乙酸乙酯中的少量乙酸:加入乙醇和浓硫酸,使乙酸全部转化为乙酸乙酯 | |
| B. | 除去苯中的少量苯酚:加入NaOH溶液,振荡、静置分层后,除去水层 | |
| C. | 做过银镜反应的试管:加入稀硝酸洗涤 | |
| D. | 提取溶解在水中的少量碘:加入CCl4,振荡、静置分层后,取出有机层再分离 |
| A. | 一氧化氮气体暴露空气中变成红棕色 | |
| B. | 盛放在无色试剂瓶中的浓硝酸呈黄色 | |
| C. | 苯滴加到溴水中,振荡后水层接近无色 | |
| D. | 二氧化硫通入品红溶液后溶液显无色 |
| A. | 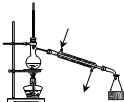 用于蒸馏石油 | B. |  用于收集NO | ||
| C. |  用于分离乙酸和乙酸乙酯混合物 | D. |  用于实验室制取NH3 |
| A. | H:Cl | B. | Na+ | C. | 188O | D. | O=C=O |
 (1)联氨(N2H4)是一种高能燃料.工业上可以利用氮气和氢气制备联氨.
(1)联氨(N2H4)是一种高能燃料.工业上可以利用氮气和氢气制备联氨.