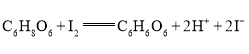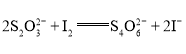题目内容
【题目】Ⅰ.在下列事实中,影响化学反应速率的因素分别为:
(1)夏天将食物存放在电冰箱里___;
(2)钠可以与冷水剧烈反应,铝与水反应必须加热____;
(3)工业制氨需要高压____。
Ⅱ.向体积为2L的恒容密闭容器中充入1molN2和3molH2,发生反应N2(g)+3H2(g)![]() 2NH3(g),达到平衡时,N2的转化率为20%,回答下列问题:
2NH3(g),达到平衡时,N2的转化率为20%,回答下列问题:
(1)平衡时,c(N2):c(H2)=___,平衡转化率α(N2):α(H2)=___;
(2)设平衡时压强为P平,反应开始时压强为P始,则P平:P始=___;
(3)若起始投料改为只加入2molNH3,则相同条件达到平衡时NH3的转化率为α(NH3)=__。
【答案】温度 物质本身性质 压强 1:3 1:1 9:10 80%
【解析】
Ⅰ.(1)夏天将食物存放在电冰箱里,可以降低反应速率,与冰箱中的低温有关;
(2)钠可以与冷水剧烈反应,铝与水反应必须加热是金属本身的性质,导致不同;
(3)压强增大可以加快工业制氨的速率;
Ⅱ.(1)因为起始投料为1:3,转化的量也为1:3,所以平衡时c(N2):c(H2)=1:3,平衡转化率α(N2):α(H2)等于1:1;
(2)设平衡时压强为P平,反应开始时压强为P始,压强之比等于物质的量之比,反应前气体的物质的量为4mol,反应后气体的总物质的量为3.6mol,则P平:P始=9:10;
(3)若起始投料改为只加入2molNH3,则相同条件达到平衡时,正向投料转化率和反向投料转化率之和为1,所以相同条件达到平衡时NH3的转化率为80%。

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案【题目】过二硫酸钠(Na2S2O8)也叫高硫酸钠,可用于废气处理及有害物质氧化降解.用(NH4)2S2O8溶液和一定浓度的NaOH溶液混合可制得Na2S2O8晶体,同时还会放出氨气。某化学兴趣小组利用该原理在实验室制备Na2S2O8晶体(装置如图所示).

已知:反应过程中发生的副反应为2NH3+3Na2S2O8+6NaOH![]() 6Na2SO4+6H2O+N2
6Na2SO4+6H2O+N2
(1)图中装有NaOH溶液的仪器的名称为___,反应过程中持续通入氮气的目的是___。
(2) (NH4)2S2O8可由电解硫酸铵和硫酸的混合溶液制得,写出电解时阳极的电极反应式:___。
(3)Na2S2O8溶于水中,会发生一定程度的水解,最终仅生成H2SO4、Na2SO4和另一种常温下为液态且具有强氧化性的物质,写出该反应的化学方程式:___。
(4)Na2S2O8具有强氧化性,该兴趣小组设计实验探究不同环境下Na2S2O8氧化性的强弱。将MnSO4H2O(1.69g)与过量Na2S2O8(10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如表格所示)。
环境 | 调节溶液氧化环境时的现象 | 加热煮沸3min期间产生的现象 |
中性 | 加入VmL蒸馏水,无明显现象 | 30s时开始有大量气泡冒出,3min后溶液变深棕色,溶液中有悬浮小颗粒 |
碱性 | 加入VmL某浓度的NaOH溶液,瞬间变为棕色(MnO2) | 10s后溶液逐渐变为深紫色(MnO4-),没有明显冒气泡现象 |
酸性 | 加入VmL稀H2SO4无明显现象 | 煮沸3min后,有气泡冒出 |
①在___(填“中性”“酸性”或“碱性”)条件下,Na2S2O8的氧化能力最强。
②中性氧化时,会产生大量气泡,其原因为___。
③若用0.1molL-1的H2O2溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为___;达到滴定终点时,消耗H2O2溶液的体积为V1rnL。则碱性氧化后的溶液中NaMnO4的质量为___ g(用含V1的代数式表示,5H2O2~2![]() )。
)。