题目内容
【题目】“空气吹出法”海水提溴的工艺流程如图:
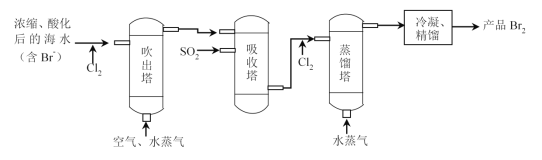
下列说法不正确的是( )
A.进入吹出塔前,Br-被氧化为Br2
B.从吸收塔流出的溶液主要含HBr和H2SO4
C.经过吸收塔后,溴元素得到富集
D.两次通入水蒸气的作用都是参加反应
【答案】D
【解析】
A.通入氯气,发生反应:Cl2+2Br-=2Cl-+Br2,溴易挥发,可用热空气吹出,因此吹出塔前,Br-被氧化为Br2,A正确,不选;
B.在吸收塔中,Br2、SO2、H2O发生氧化还原反应:Br2+SO2+2H2O=2HBr+H2SO4,所以从吸收塔流出的溶液主要含有溶质HBr和H2SO4,B正确,不选;
C.经过吸收塔后,可使溶液中的Br-远大于进入吸收塔之前的海水中Br-的浓度,溴元素得到富集,C正确,不选;
D.在吹出塔中吹入水蒸气,可提高物质的能量,有助于溴挥发逸出,没有参加反应;在蒸馏塔中,发生反应:Cl2+2Br-=2Cl-+Br2,水作为溶剂,使物质发生反应,同时提供能量,使反应产生的溴单质变为蒸气,经冷凝、精馏得到产品,可见两次通入水蒸气都未参加反应,D错误,符合题意;
答案选D。

 名校课堂系列答案
名校课堂系列答案【题目】实验小组制备NaNO2,并探究其性质。
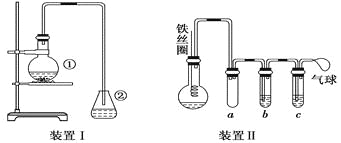
I.制备NaNO2
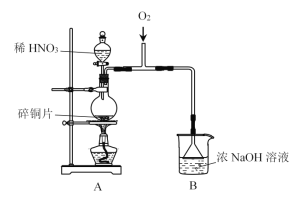
(1)A中发生反应的化学方程式是__________。
(2)B中选用漏斗替代长直导管的优点是________。
(3)为检验B中制得NaNO2,甲进行以下实验:
序号 | 试管 | 操作 | 现象 |
① | 2 mLB中溶液 | 加2 mL 0.1 mol/LKI溶液,滴加几滴淀粉溶液 | 不变蓝 |
② | 2 mLB中溶液 | 滴加几滴H2SO4至pH=5,加2 mL 0.1 mol/LKI溶液,滴加几滴淀粉溶液 | 变蓝 |
③ | 2 mLH2O | 滴加几滴H2SO4至pH=5,加2 mL 0.1 mol/LKI溶液,滴加几滴淀粉溶液 | 不变蓝 |
实验③的目的是________。
(4)乙认为上述3组实验无法证明B中一定含NaNO2,还需补充实验,理由是_________。
II.探究NaNO2的性质
装置 | 操作 | 现象 |
| 取10 mL1 mol/LNaNO2溶液于试剂瓶中,加入几滴H2SO4酸化,再加入10 mL1 mol/LFeSO4溶液,迅速塞上橡胶塞,缓缓通入足量O2。 | i.溶液迅速变为棕色; ii.溶液逐渐变浅,有无色气泡产生,溶液上方为浅红棕色。 iii.最终形成棕褐色溶液。 |
资料:i.[Fe(NO)]2+在溶液中呈棕色。
ii.HNO2在溶液中不稳定,易分解产生NO和NO2气体。
(5)溶液迅速变为棕色的原因是_________。
(6)已知棕色溶液变浅是由于生成了Fe3+,反应的离子方程式是_________。
(7)最终棕褐色溶液的成分是Fe(OH)x(SO4)y,测得装置中混合溶液体积为20 mL,设计如下实验测定其组成。
资料:充分反应后,Fe2+全部转化为Fe(OH)x(SO4)y。
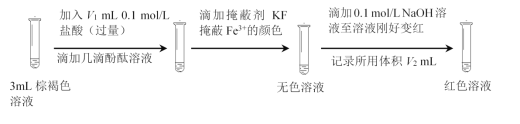
Fe(OH)x(SO4)y中x=_______(用含V1、V2的代数式表示)。