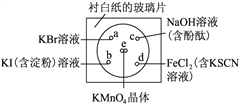
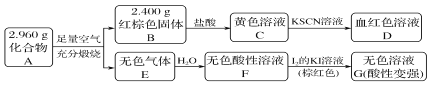
题目内容
【题目】(1)当SO2、SO3的分子个数之比为1∶1时,原子总数之比为________,质量之比为________。
(2)中和含0.2 mol HCl的稀盐酸,需NaOH的质量为________g。
(3)将5 mol·L-1的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO![]() 的物质的量浓度是______ mol·L-1。
的物质的量浓度是______ mol·L-1。
(4)用等体积的0.1 mol·L-1的BaCl2溶液,可使相同体积的Fe2(SO4)3、Na2SO4、KAl(SO4)2三种溶液中的SO![]() 都恰好完全沉淀,则三种硫酸盐的物质的量浓度之比为________。
都恰好完全沉淀,则三种硫酸盐的物质的量浓度之比为________。
【答案】3∶4 4∶58![]() 2∶6∶3
2∶6∶3
【解析】
(1)SO2为三原子分子,SO3为四原子分子,故当SO2、SO3的分子数相同时,原子总数之比为3∶4,质量之比等于它们的摩尔质量之比,即为64 g·mol-1∶80 g·mol-1=4∶5,故答案为: 3∶4、4∶5;(2)n(NaOH)=n(HCl)=0.2 mol,m(NaOH)=0.2 mol×40 g·mol-1=8 g,故答案为:8;(3)稀释前后NO![]() 的物质的量不变,即c(NO
的物质的量不变,即c(NO![]() )×b mL=2×5 mol·L-1×a mL,则稀释后c(NO
)×b mL=2×5 mol·L-1×a mL,则稀释后c(NO![]() )=
)=![]() mol·L-1;(4)由题意可知,三种溶液中的SO
mol·L-1;(4)由题意可知,三种溶液中的SO![]() 的物质的量相等,即3n[Fe2(SO4)3]=n(Na2SO4)=2n[KAl(SO4)2],则n[Fe2(SO4)3]∶n(Na2SO4)∶n[KAl(SO4)2]=
的物质的量相等,即3n[Fe2(SO4)3]=n(Na2SO4)=2n[KAl(SO4)2],则n[Fe2(SO4)3]∶n(Na2SO4)∶n[KAl(SO4)2]=![]() ∶1∶
∶1∶![]() =2∶6∶3;又因三种溶液体积相同,则三种硫酸盐的物质的量浓度之比等于其物质的量之比,故答案为:2∶6∶3。
=2∶6∶3;又因三种溶液体积相同,则三种硫酸盐的物质的量浓度之比等于其物质的量之比,故答案为:2∶6∶3。

 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
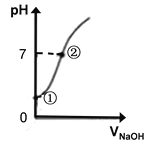
学练快车道快乐假期暑假作业新疆人民出版社系列答案【题目】(1)用0.lmol·L-1NaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
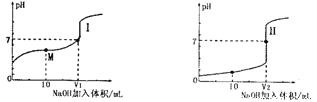
①滴定醋酸的曲线是__________(填“I”或“Ⅱ”)。
②V1和V2的关系:V1______V2(填“>”、“=”或“<”)
③M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是_______________。
(2)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。资料:AgSCN是白色沉淀
操作步骤 | 现象 |
步骤1:向2mL0.005mol·L-1AgNO3溶液中 加入2mL0.005mol·L-1KSCN溶液,静置 | 出现白色沉淀 |
步骤2:取lmL上层清液于试管中,滴加1 滴2 mol·L-1Fe(NO3)3溶液 | 溶液变红色 |
步骤3:向步骤2的溶液中,继续加入5滴3mol·L-1 AgNO3溶液 | 出现白色沉淀,溶液红色变浅 |
步骤4:向步骤1余下的浊液中加入5滴3 mol·L-1 KI溶液 | 出现黄色沉淀 |
①写出步骤2中溶液变红色的离子方程式______________________。
②用化学平衡原理解释步骤3的实验现象______________________。