题目内容
【题目】(1)如图进行实验,将a溶液逐渐加入盛b溶液的试管中,写出试管中观察到的现象及对应的离子方程式。
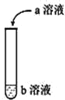
a | b | 试管中现象 | 离子方程式 |
Na2CO3 | 稀盐酸 | ________________ | _________ |
稀盐酸 | Na2CO3 | ______________ | _______________ |
(2)工业上利用NaIO3和NaHSO3反应来制取单质I2。配平下列化学方程式并用单线桥法表示电子转移的方向和数目:
_____NaIO3+_____NaHSO3=_____I2+_____Na2SO4+_____H2SO4+_____H2O
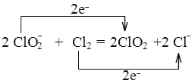
(3)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取![]() 。写出该反应的离子方程式,并用双线桥法表示电子转移的方向和数目_____________________。
。写出该反应的离子方程式,并用双线桥法表示电子转移的方向和数目_____________________。
【答案】立刻产生气泡 ![]() +2H+ =H2O + CO2↑ 开始时无气泡,后来有气泡
+2H+ =H2O + CO2↑ 开始时无气泡,后来有气泡 ![]() + H+ =
+ H+ = ![]() 、
、![]() + H+ =H2O + CO2↑ 4 10 2 7 3 2
+ H+ =H2O + CO2↑ 4 10 2 7 3 2 ![]() +Cl2=2ClO2+2Cl-
+Cl2=2ClO2+2Cl-
【解析】
(1)将碳酸钠溶液滴入到稀盐酸中,盐酸过量,开始就产生气泡,其离子反应方程式为:![]() +2H+=H2O+CO2↑;将稀盐酸滴入到碳酸钠溶液中,盐酸少量,开始时无气泡,后来产生气泡,其离子反应方程式为:
+2H+=H2O+CO2↑;将稀盐酸滴入到碳酸钠溶液中,盐酸少量,开始时无气泡,后来产生气泡,其离子反应方程式为:![]() +H+=
+H+=![]() 、
、![]() +H+=H2O+CO2↑;故答案为:立刻产生气泡;
+H+=H2O+CO2↑;故答案为:立刻产生气泡;![]() +2H+=H2O+CO2↑;开始时无气泡,后来有气泡;
+2H+=H2O+CO2↑;开始时无气泡,后来有气泡;![]() +H+=
+H+=![]() 、
、![]() +H+=H2O+CO2↑;
+H+=H2O+CO2↑;
(2) NaIO3溶液中滴加少量NaHSO3溶液时,![]() 被氧化成
被氧化成![]() ,
,![]() 被还原成I2,根据电子守恒和元素守恒,该反应为:4NaIO3+
被还原成I2,根据电子守恒和元素守恒,该反应为:4NaIO3+
10NaHSO3═2I2+7Na2SO4+3H2SO4+2H2O,该反应中转移的电子数为20e-,故答案为:4;10;2;7;3;2;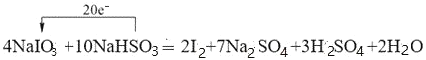 ;
;
(3) Cl2氧化NaClO2溶液制取ClO2,本身被还原为氯离子,1个氯气分子反应得到2个电子,因此离子反应方程式为:![]() +Cl2=2ClO2+2Cl-;双线桥法表示电子转移的方向和数目为:
+Cl2=2ClO2+2Cl-;双线桥法表示电子转移的方向和数目为: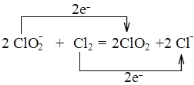 ;故答案为:
;故答案为:+Cl2=2ClO2+2Cl-;
 。
。

【题目】活性氧化锌是一种多功能性的新型无机材料。某小组以粗氧化锌(含铁、铜的氧化物)为原料模拟工业生产活性氧化锌,步骤如图: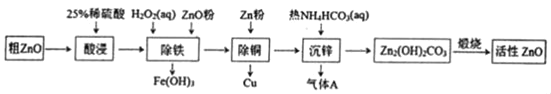
已知相关氢氧化物沉淀pH范围如表所示
Zn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀 | 5.4 | 7.0 | 2.3 | 4.7 |
完全沉淀 | 8.0 | 9.0 | 4.1 | 6.7 |
下列说法不正确的是( )
A.“酸浸”中25%稀硫酸可用98%浓硫酸配制,需玻璃棒、烧杯、量简、胶头滴管等仪器
B.“除铁”中用ZnO粉调节溶液pH至4.1~4.7
C.“除铜”中加入Zn粉过量对制备活性氧化锌的产量没有影响
D.“沉锌”反应为2Zn2++4HCO3﹣═Zn2(OH)2CO3↓+3CO2↑+H2O