题目内容
【题目】已知:还原性强弱:I- >Fe2+>Br-,向仅含Fe2+、I-、Br-的溶液中通入适量氯气,溶液中这三种离子的物质的量随消耗氯气物质的量的变化如图所示。下列说法中正确的是
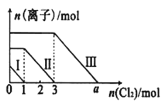
A.a值等于6
B.线段Ⅰ代表Br-的变化情况
C.线段Ⅲ代表Fe2+的变化情况
D.原混合溶液中n(FeBr2)=4mol
【答案】A
【解析】
向仅含Fe2+、I-、Br-的溶液中通入适量氯气,还原性强弱:I->Fe2+>Br-,首先发生反应:2I-+Cl2=I2+2Cl-,I-反应完毕,再发生反应:2Fe2++Cl2=2Fe3++2Cl-,Fe2+反应完毕,最后发生反应:2Br-+Cl2=Br2+2Cl-,故线段Ⅰ代表I-的变化情况,线段Ⅱ代表Fe2+的变化情况,线段Ⅲ代表Br-的变化情况;通入氯气,根据反应离子方程式,n(I-)=2n(Cl2)=2mol,n(Fe2+)=2n(Cl2)=2×(3mol-1mol)=4mol,Fe2+反应完毕,根据电荷守恒,n(I-)+ n(Br-)=2n((Fe2+),故n(Br-)=2n((Fe2+)- n(I-)=2×4mol-2mol=6mol,据此分析作答。
A.溶液中n(Br-)=2n((Fe2+)- n(I-)=2×4mol-2mol=6mol,根据2Br-+Cl2=Br2+2Cl-可知,溴离子反应需要的氯气的物质的量为3mol,故a=3+3=6,A正确;
B.线段Ⅰ代表I-的变化情况,B错误;
C.线段Ⅲ代表Br-的变化情况,C错误;
D.n((Fe2+)=2n(Cl2)=2×(3mol-1mol)=4mol,而n(Br-)=2n((Fe2+)- n(I-)=2×4mol-2mol=6mol,则原混合溶液中n(FeBr2)=![]() n(Br-)=3mol,D错误;
n(Br-)=3mol,D错误;
故答案为:A。

【题目】已知下列物质在20℃下的Ksp如下,
化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
Ksp | 2.0×10-10 | 5.4×10-13 | 8.3×10-17 | 2.0×10-48 | 2.0×10-12 |
下列说法不正确的是
A. 20℃时,上述五种银盐饱和溶液中,Ag+物质的量浓度由大到小的顺序是:Ag2CrO4>AgCl>AgBr>AgI>Ag2S。
B. 向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,c(Br -) /(Cl -)=2.7×10-3
C. 测定水体中氯化物的含量,常用标准硝酸银法进行滴定,滴定时,应加入的指示剂是K2CrO4
D. 某溶液中含有Cl-、Br-和I-,浓度均为0.010 mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,Cl-最先沉淀出来
【题目】(1)如图进行实验,将a溶液逐渐加入盛b溶液的试管中,写出试管中观察到的现象及对应的离子方程式。
a | b | 试管中现象 | 离子方程式 |
Na2CO3 | 稀盐酸 | ________________ | _________ |
稀盐酸 | Na2CO3 | ______________ | _______________ |
(2)工业上利用NaIO3和NaHSO3反应来制取单质I2。配平下列化学方程式并用单线桥法表示电子转移的方向和数目:
_____NaIO3+_____NaHSO3=_____I2+_____Na2SO4+_____H2SO4+_____H2O
(3)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取![]() 。写出该反应的离子方程式,并用双线桥法表示电子转移的方向和数目_____________________。
。写出该反应的离子方程式,并用双线桥法表示电子转移的方向和数目_____________________。
【题目】一定量的Na2CO3和NaHCO3的均匀混合物分成质量不等的三份,分别与50mL相同浓度的盐酸反应,得到气体的质量与固体混合物的质量关系如下表所示:
组 别 | 1 | 2 | 3 |
固体质量/g | 3.80 | 6.20 | 7.20 |
气体质量/g | 1.76 | 2.64 | 2.64 |
(1)上表中_______组数据表明盐酸参加反应后有剩余,理由是______________。
(2)上表中第2组数据中盐酸____________(填“过量”、“适量”、“不足量”)。
(3)通过计算求Na2CO3和NaHCO3的质量分数各为_________、____________。
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向苯酚浊液中滴加Na2CO3溶液,浊液变清 | 苯酚的酸性强于H2CO3的酸性 |
B | 向碘水中加入等体积CCl4,振荡后静置,上层接近无色,下层显紫红色 | I2在CCl4中的溶解度大于在水中的溶解度 |
C | 向CuSO4溶液中加入铁粉,有红色固体析出 | Fe2+的氧化性强于Cu2+的氧化性 |
D | 向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成 | Ksp(AgCl) >Ksp(AgI) |
A. A B. B C. C D. D