题目内容
下列说法不正确的是( )
| A、最外层电子数为2的元素一定处于ⅡA族 |
| B、Ba(OH)2是离子化合物,既含离子键又含共价键 |
| C、Na的原子半径比Cl的大,但Na+的半径比Cl-的小 |
| D、Cl与Ⅰ同属ⅦA族元素,两者最高价氧化物对应水化物的酸性HClO4>HIO4 |
考点:元素周期表的结构及其应用,元素周期律的作用,微粒半径大小的比较,离子化合物的结构特征与性质
专题:元素周期律与元素周期表专题
分析:A.最外层电子数为2的元素不一定处于ⅡA族;
B.氢氧化钡中存在离子键和共价键;
C.同一周期元素中,原子半径随着原子序数的增大而减小,离子的电子层数越多其离子半径越大;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强.
B.氢氧化钡中存在离子键和共价键;
C.同一周期元素中,原子半径随着原子序数的增大而减小,离子的电子层数越多其离子半径越大;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强.
解答:
解:A.最外层电子数为2的元素不一定处于ⅡA族,如He及部分副族元素等,故A错误;
B.氢氧化钡中氢氧根离子和钡离子之间存在离子键、O原子和H原子之间存在共价键,所以氢氧化钡中存在离子键和共价键,故B正确;
C.同一周期元素中,原子半径随着原子序数的增大而减小,离子的电子层数越多其离子半径越大,所以Na的原子半径比Cl的大,但Na+的半径比Cl-的小,故C正确;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性Cl>I,所以两者最高价氧化物对应水化物的酸性HClO4>HIO4,故D正确;
故选A.
B.氢氧化钡中氢氧根离子和钡离子之间存在离子键、O原子和H原子之间存在共价键,所以氢氧化钡中存在离子键和共价键,故B正确;
C.同一周期元素中,原子半径随着原子序数的增大而减小,离子的电子层数越多其离子半径越大,所以Na的原子半径比Cl的大,但Na+的半径比Cl-的小,故C正确;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性Cl>I,所以两者最高价氧化物对应水化物的酸性HClO4>HIO4,故D正确;
故选A.
点评:本题考查了元素周期表结构和元素性质,根据原子结构结合元素周期律分析解答,注意规律中的反常现象,易错选项是A.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
 2013年12月14日,嫦娥三号顺利月面软着陆,月球车表面包裹F46膜,F46膜是由四氟乙烯和全氟丙烯共聚而成.下列有关说法正确的是( )
2013年12月14日,嫦娥三号顺利月面软着陆,月球车表面包裹F46膜,F46膜是由四氟乙烯和全氟丙烯共聚而成.下列有关说法正确的是( )| A、F46膜是纯净物 |
| B、全氟丙烯属于有机物 |
| C、全氟丙烯所有原子共平面 |
| D、四氟乙烯分子中只含非极性键 |
氯化铁溶液与氢氧化铁胶体的共同点是( )
| A、分散质颗粒直径都在l~100nm之间 |
| B、颜色都呈红褐色 |
| C、一束平行光照射溶液时,从侧面都可以看到一束光束 |
| D、都是分散系 |
下列叙述与对应图式正确的是( )
A、由下列短周期元素性质的数据推断元素③最高价氧化物对应的水化物碱性最强
| |||||||||||||||||||||||||||||||||||
B、图甲表示Zn-Cu原电池反应过程中的电流强度的变化,T时可能加入了H2O2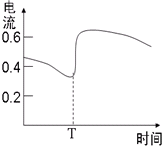 | |||||||||||||||||||||||||||||||||||
C、图乙表示某一放热反应,若使用催化剂E1、E2、△H都会发生改变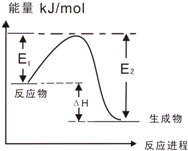 | |||||||||||||||||||||||||||||||||||
| D、表示H2燃烧热的热化学方程式为:2H2(g)+O2(g)═2H2O(l);△H=-571.6kJ/mol |
下面是常见的电化学装置图,①③④中均为惰性电极,下列说法正确的是( )
A、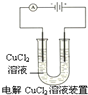 阴极反应式为:2Cl--2e-=Cl2↑,阳极反应式为:Cu2++2e-=Cu |
B、 铜片为阳极,若铜片和铁制品的质量相等,电解一段时间后,电路中有2mol电子转移,此时铜片和铁制品的质量差为128g |
C、 b极为负极,该极的电极反应方程式为O2+2H2O+4e-=4OH- |
D、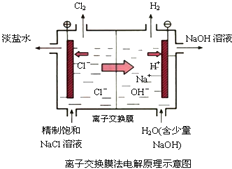 阳离子交换膜上每透过1mol Na+时,则阴极上产生11.2L H2 |
下列有关电化学原理的说法错误的是( )
| A、氯化铝的熔点比氧化铝低,因此工业上最好采用电解熔融氯化铝来制备单质铝 |
| B、电镀时,通常把待镀的金属制品作阴极,把镀层金属作阳极 |
| C、对于冶炼像钠、钙、镁、铝等这样活泼的金属,电解法几乎是唯一可行的工业方法 |
| D、对大型船舶的外壳进行的“牺牲阳极的阴极保护法”,是应用了原电池原理 |
某元素原子的最外层有1个电子,则该元素不可能是( )
| A、IA族元素 | B、金属元素 |
| C、非金属元素 | D、惰性元素 |
化学与生命、材料、能源等科学密切联系.下列有关化学发展方向的说法不正确的是( )
| A、研究新药物,预防和治疗人类的疾病 |
| B、研究高效、高残留农药,提高粮食产量 |
| C、开发光电转换材料,充分利用太阳能 |
| D、开发高效的模拟酶催化剂,减少对化肥的依赖 |