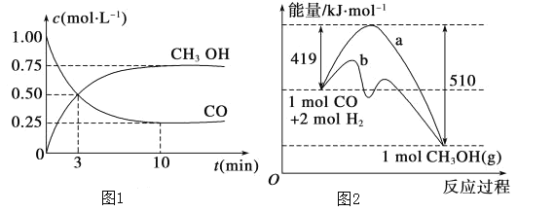
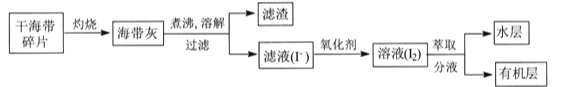
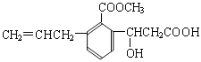
题目内容
【题目】将一定质量的镁铝合金投入100 mL一定浓度的盐酸中,合金完全溶解,向所得溶液中滴加浓度为0.5 mol/L的NaOH溶液,生成的沉淀质量跟加入的NaOH溶液的体积关系如图。(横坐标体积单位是mL,纵坐标质量单位是g)
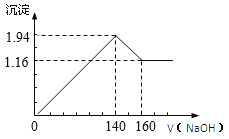
求:(1)合金中Mg,Al的质量_______________;
(2)所用HCl的物质的量浓度_______________。
【答案】m(Mg)=4.8 g,m(Al)=0.27 g 0.7 mol/L
【解析】
(1)由图可知,从加入氢氧化钠溶液就开始产生沉淀,加入氢氧化钠溶液为140 mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液为NaCl,根据元素守恒可知n(HCl)=n(NaOH),利用NaOH的物质的量及溶液的体积计算HCl的物质的量,结合HCl的体积,利用物质的量浓度定义式计算盐酸的浓度;该阶段消耗氢氧化钠140 mL,由氢氧根守恒可知3n[Al(OH)3]+2n[Mg(OH)2]=n(NaOH);从加入氢氧化钠溶液140 mL~160 mL溶解氢氧化铝,该阶段发生反应Al(OH)3+NaOH=NaAlO2+2H2O,利用该阶段中NaOH与Al(OH)3的物质的量,计算Al的物质的量和质量,结合总质量计算出原混合物中Al的质量。
(1)假设原混合物中Mg、Al的物质的量分别是x、y,沉淀最大值时Mg、Al形成的Mg2+、Al3+完全转化为Mg(OH)2和Al(OH)3,58x+78y=1.94g,在加入氢氧化钠溶液140 mL~160 mL溶解氢氧化铝,该阶段发生反应Al(OH)3+NaOH=NaAlO2+2H2O,n(NaOH)=c·V=0.5 mol/L×0.02 L=0.01 mol,则n[Al(OH)3]=n(NaOH)=0.01 mol,n(Al)=0.01 mol,m[Al(OH)3]=0.01 mol×78 g/mol=0.78 g,根据Al元素守恒可知m(Al)=n·M=0.01 mol×27 g/mol=0.27 g;m[Mg(OH)2]=1.16g,n[Mg(OH)2]=![]() =0.02 mol,所以根据Mg元素守恒可知Mg的质量为m(Mg)=0.02 mol×24 g/mol=0.48 g;
=0.02 mol,所以根据Mg元素守恒可知Mg的质量为m(Mg)=0.02 mol×24 g/mol=0.48 g;
(2)加入氢氧化钠溶液为140 mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液为氯化钠溶液,根据钠元素守恒此时溶液中n(NaCl)=n(NaOH)= 0.5 mol/L×0.14 L=0.07 mol,根据氯元素守恒n(HCl)=0.07 mol,所以根据物质的量浓度定义式可得盐酸的物质的量浓度为c=![]() =0.7 mol/L。
=0.7 mol/L。

【题目】下表列出了①~⑨九种元素在周期表中的位置.
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ||||||
4 | ⑧ | ⑨ |
请按要求回答下列问题.
(1)这九种元素中,原子半径最大的是(填元素符号)__;元素⑤的原子结构示意图为___.
(2)③、④、⑤三种元素的气态氢化物中,热稳定性最弱的物质是(填化学式)______.
(3)写出元素⑧的单质与水反应的化学方程式:______.
(4)写出元素⑦的单质与元素⑨的钠盐溶液反应的离子方程式:______.