题目内容
8.下列各组离子,在所给条件下一定能大量共存的是( )| A. | pH=0 的溶液中:Mg2+、Fe3+、NO3-、SO42- | |
| B. | 能和Ca2+生成沉淀的溶液中:Ba2+、K+、CH3COO-、Cl- | |
| C. | 能使碘化钾淀粉试纸变蓝的溶液:Na+、NH4+、S2-、SO32- | |
| D. | 由水电离出的c(OH-)=1×10-13mol/L的溶液中:NH4+、Al3+、NO3-、Cl- |
分析 A.pH=0的溶液中存在大量氢离子,四种离子之间不反应,都不与氢离子反应;
B.能够与钙离子反应生成沉淀的溶液中存在亚硫酸根离子、碳酸根离子或硫酸根等离子,钡离子能够与碳酸根离子、亚硫酸根离子、硫酸根离子反应生成沉淀;
C.能使碘化钾淀粉试纸变蓝的溶液检验氧化性,硫离子、亚硫酸根离子能够被氧化;
D.由水电离出的c(OH-)=1×10-13mol/L的溶液中存在大量氢离子或氢氧根离子,铵根离子、硫离子与氢氧根离子反应.
解答 解:A.pH=0的溶液为强酸性溶液,Mg2+、Fe3+、NO3-、SO42-之间不发生反应,都不与强酸性溶液反应,在溶液中能够大量共存,故A正确;
B.Ba2+能够与和Ca2+生成沉淀的离子反应生成沉淀,在溶液中不能大量共存,故B错误;
C.能使碘化钾淀粉试纸变蓝的溶液检验强氧化性,S2-、SO32-在溶液中能够被氧化,不能大量共存,故C错误;
D.由水电离出的c(OH-)=1×10-13mol/L的溶液为酸性或碱性溶液,NH4+、Al3+与碱性溶液中的氢氧根离子反应,在溶液中不能大量共存,故D错误;
故选A.
点评 本题考查离子共存的判断,为高考中的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
18.影响化学反应速率的因素很多,某化学兴趣小组进行化学反应速率影响因素的探究实验:KI在经酸化的溶液中被空气氧化的反应式为:4H++4I-+O2═2I2+2H2O.该反应的速率受温度、酸度、溶剂、试剂浓度等影响,可用淀粉与碘的显色反应来观测该反应的速率.已知,淀粉与碘的显色反应在温度升高时灵敏度会降低,高于75℃则不能显色;淀粉浓度越高显色越灵敏、颜色也越深.
实验小组拟用0.8mol•L-1KI溶液、0.1mol•L-1H2SO4溶液、淀粉溶液等来探究温度、酸度对上述反应速率的影响,他们做了A-C三组实验,部分实验数据如下表:
(1)为确保A组实验在39℃下进行,应采用的控温操作方法是将量出的各种溶液分别装在试管中,再将试管全部放在同一水浴中加热,用温度计测量试管中溶液的温度.
(2)A-C三组实验时,都加入了5mL水,其目的是为了在后续研究酸度因素对反应速率影响时保持KI和淀粉浓度不变(凡表达出“控制变量”、“对比实验”意思的各种合理答案都得分).
(3)B组实验中“没出现蓝色”,原因是温度(TB)高于75℃,淀粉与碘不显色.
(4)请你为小组设计D组实验方案(在表格空白处填入你设计的5个数据),以帮助小组完成探究目标.
(5)按你设计的实验数据,请你预测一个t值,并写出与你预测相对应的探究实验结论设计酸体积<10mL时,t预测值要小于同温对比值;设计酸体积>10mL时,t预测值要大于同温对比值,结论:酸度越大反应速率越快.
实验小组拟用0.8mol•L-1KI溶液、0.1mol•L-1H2SO4溶液、淀粉溶液等来探究温度、酸度对上述反应速率的影响,他们做了A-C三组实验,部分实验数据如下表:
| 编号 | 温度/℃ | H2SO4体积/mL | KI溶液体积/mL | H2O体积/mL | 淀粉溶液 /mL | 出现蓝色时间/s |
| A | 39 | 10 | 5 | 5 | 1 | 5 |
| B | TB | 10 | 5 | 5 | 1 | 没出现蓝色 |
| C | 5 | 10 | 5 | 5 | 1 | 39 |
| D | t |
(2)A-C三组实验时,都加入了5mL水,其目的是为了在后续研究酸度因素对反应速率影响时保持KI和淀粉浓度不变(凡表达出“控制变量”、“对比实验”意思的各种合理答案都得分).
(3)B组实验中“没出现蓝色”,原因是温度(TB)高于75℃,淀粉与碘不显色.
(4)请你为小组设计D组实验方案(在表格空白处填入你设计的5个数据),以帮助小组完成探究目标.
(5)按你设计的实验数据,请你预测一个t值,并写出与你预测相对应的探究实验结论设计酸体积<10mL时,t预测值要小于同温对比值;设计酸体积>10mL时,t预测值要大于同温对比值,结论:酸度越大反应速率越快.
16.人的体味中存在两种名为AND和EST的荷尔蒙,结构如图所示.下列说法不正确的是( )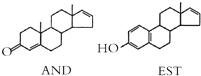

| A. | AND和EST都能使酸性 KMnO4溶液褪色 | |
| B. | AND和EST两者的相对分子质量之差为14 | |
| C. | AND和EST分别与足量氢气加成后的两种生成物互为同系物 | |
| D. | AND和EST与溴水完全反应消耗溴单质的物质的量之比为2:3 |
3.下列化学反应的离子方程式正确的是( )
| A. | 在稀氨水中通入过量CO2:NH3•H2O+CO2=NH4++HCO3- | |
| B. | SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO | |
| C. | 向Ba(OH)2溶液中加入少量的NaHSO3溶液2HSO3-+Ba2++2OH-→BaSO3↓+SO32-+2H2O | |
| D. | 氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO42-=CaSO4↓+H2O |
13.食盐,食醋,纯碱(Na2CO3)均为家庭厨房中常用的物质,利用这些物质不能完成的实验是( )
| A. | 鉴别AgNO3溶液和BaCl2溶液 | B. | 检验鸡蛋壳(CaCO3)能否溶于酸 | ||
| C. | 检验自来水中是否含Cl- | D. | 除去热水瓶内壁上的水垢 |
20.氰气[(CN)2]和氰化物都是剧毒性物质,氰分子的结构式为N≡C-C≡N,性质与卤素相似,下列叙述错误的是( )
| A. | 氰分子中四原子共直线,是非极性分子 | |
| B. | 氰分子中N的杂化类型为SP | |
| C. | 氰气分子中含有σ键和π键 | |
| D. | 氰分子中C≡N键长大于C≡C键长 |
17.恒温下,在容积不变的密闭容器中将N2和H2混合,使其在一定条件下发生反应:N2(g)+3H2(g)?2NH3(g),并达到化学平衡,根据表中数据回答有关问题
(1)表中a=2.5,e=1.5
(2)若反应经3min达到平衡,则反应速率v(N2)=0.5mol•L-1•min-1;
(3)该反应体系的起始状态与平衡状态的压强之比为17:11;
(4)上述反应过程中,如果降低温度,则反应速度减小(填“增大”或“减小”“不变”).
(5)下列各项中,可以说明上述反应达到平衡的是BCD(填序号)
A.混合气体的密度不再变化
B.混合气体的压强不再变化
C.N2的正反应速率等于逆反应速率
D.N2的浓度保持恒定不变.
| 物质的量浓度 | N2 | H2 | NH3 |
| 起始/mol•L-1 | a | 6 | 0 |
| 转化/mol•L-1 | b | c | d |
| 平衡/mol•L-1 | 1 | e | 3 |
(2)若反应经3min达到平衡,则反应速率v(N2)=0.5mol•L-1•min-1;
(3)该反应体系的起始状态与平衡状态的压强之比为17:11;
(4)上述反应过程中,如果降低温度,则反应速度减小(填“增大”或“减小”“不变”).
(5)下列各项中,可以说明上述反应达到平衡的是BCD(填序号)
A.混合气体的密度不再变化
B.混合气体的压强不再变化
C.N2的正反应速率等于逆反应速率
D.N2的浓度保持恒定不变.
18.下列操作不合适的是( )
| A. | 银镜反应采用水浴加热 | |
| B. | 用通过盛溴水的洗气瓶的方法除去甲烷气体中含有的乙烯杂质 | |
| C. | 在乙醛还原新制Cu(OH)2悬浊液的实验中,制Cu(OH)2悬浊液时应保持NaOH过量,可直接加热 | |
| D. | 配制银氨溶液时,将AgNO3溶液滴入氨水中 |