题目内容
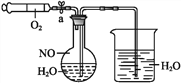
【题目】Ⅰ.亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂。在NaOH溶液中ClO2与H2O2反应可以得到亚氯酸钠。
(1)在制备亚氯酸钠的反应中ClO2作___(填“氧化剂”或“还原剂”);若反应中生成1 mol NaClO2,转移电子的物质的量为__。
(2)该反应的化学方程式为__。
Ⅱ.有一瓶澄清的溶液,其中可能含有NH4+、K+、Ba2+、Al3+、Fe3+、I-、NO3-、CO32-、SO42-、[Al(OH)4]-。取该溶液进行以下实验:
①用pH试纸检测,溶液呈强酸性。
②取溶液适量,加入少量CCl4和数滴新制氯水,振荡,CCl4层呈紫红色。
③另取溶液适量,逐滴加入NaOH溶液:
a.溶液从酸性变为中性;
b.溶液中逐渐产生沉淀;
c.沉淀完全溶解;
d.最后加热溶液,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
④取适量③得到的碱性溶液,加入Na2CO3溶液,有白色沉淀生成。
根据上述实验现象,回答下列问题。
(1)由①可以排除___的存在。
(2)由②可以证明___的存在;同时排除___的存在。
(3)由③可以证明___的存在。
(4)由④可以排除SO42-的存在,同时证明Ba2+的存在。
(5)写出c、d所涉及的化学方程式,是离子反应的用离子方程式表示:
c.___;
d.___。
【答案】氧化剂 1mol 2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O CO32-、[Al(OH)4]- I- Fe3+、NO3- Al3+、NH4+ Al(OH)3+OH-=AlO2-+2H2O NH3·H2O![]() NH3↑+H2O
NH3↑+H2O
【解析】
ⅠClO2与H2O2反应生成NaClO2,Cl元素的化合价降低,则H2O2中O元素的化合价升高。
Ⅱ.①用pH试纸检测,溶液呈强酸性,说明溶液中存在H+;依据离子共存可知一定不存在CO32-,[Al(OH)4]-;
②取溶液适量,加入少量CCl4和数滴新制氯水,振荡,CCl4层呈紫红色,说明溶液中一定含有I-,依据离子共存分析判断可知,一定不含有Fe3+、NO3-;
③另取溶液适量,逐滴加入NaOH溶液;
a.溶液从酸性变为中性,中和酸;
b.溶液逐渐产生沉淀,分析阳离子中只有铝离子沉淀;
c.沉淀完全溶解,证明生成的沉淀是氢氧化铝,原溶液中一定含有Al3+;
d.最后加热溶液,有气体放出,该气体能使湿润的红色石蕊试纸变蓝,证明生成的气体是氨气,原溶液中一定含有铵根离子;
④取适量③得到的碱性溶液,铝离子反应生成偏铝酸根离子,加入Na2CO3溶液,有白色沉淀生成,分析离子可知只有钡离子生成碳酸钡沉淀,说明原溶液中不含有硫酸根离子;
Ⅰ(1)ClO2中Cl元素的化合价降低,被还原,则ClO2作氧化剂,反应中生成1molNaClO2,转移电子物质的量为1mol;
故答案为:氧化剂;1mol;
(2)由分析可知,反应的方程式为:2ClO2+H2O2+2NaOH═2NaClO2+O2↑+2H2O;
Ⅱ:(1)①用pH试纸检验,溶液呈强酸性,溶液中存在大量H+,由于碳酸根离子和偏铝酸根离子都是弱酸阴离子和氢离子反应,所以CO32-,[Al(OH)4]-不能大量存在;故答案为:CO32- 、[Al(OH)4]-;
(2)CCl4层出现碘单质的颜色证明含I-,Fe3+、NO3-在该环境中与I-不能共存,依据离子共存同时排除Fe3+、NO3-离子的存在,
故答案为:I-;Fe3+、NO3-;
(3)根据分析可知③证明溶液中一定含有Al3+,NH4+;故答案为:Al3+、NH4+;
(5)c、d所涉及的化学反应为氢氧化铝溶解于氢氧化钠溶液中生成偏铝酸钠,一水合氨受热分解生成氨气, 故答案为:Al(OH)3+OH-=AlO2-+2H2O;NH3·H2O![]() NH3↑+H2O ;
NH3↑+H2O ;

【题目】某无色稀溶液X中,可能含有下表所列离子中的某几种。
阴离子 | CO |
阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂Y体积(V)的关系如图所示,下列说法正确的是( )
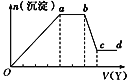
A.若Y是盐酸,则Oa段转化为沉淀的离子(上表中,下同)只有[Al(OH)4]-
B.若Y是盐酸,则溶液中可能含有的阳离子是Al3+
C.若Y是NaOH溶液,则bc段反应的离子方程式为Al(OH)3+OH-=[Al(OH)4]-
D.若Y是NaOH溶液,则X溶液中只存在四种离子,是Al3+、Fe3+、NH4+、Cl-