题目内容
12.现有如下两个反应:(A)NaOH+HCl=NaCl+H2O
(B)2FeCl3+Cu=2FeCl2+CuCl2
(1)根据两反应本质,判断能否设计成原电池(1)不能,(B)可以
(2)如果不能,说明其原因(A)的反应非氧化还原反应,没有电子转移
(3)如果可以,则写出正、负极材料及其电极反应式负极:铜,Cu-2e-=Cu2+;正极:碳棒,2Fe3++2e-=2Fe2+,电解质溶液名称氯化铁溶液.
分析 (1)原电池反应必须是自发进行的放热的氧化还原反应,根据是否有电子转移判断是否能设计成原电池;
(2)原电池反应必须是自发进行的放热的氧化还原反应;
(3)原电池反应中,化合价升高的金属单质作负极,不如负极活泼的金属或导电的非金属作正极,得电子化合价降低的电解质溶液作该原电池电解质溶液.
解答 解:(1)原电池反应必须是自发进行的放热的氧化还原反应,(A)中各元素化合价不变,所以不是氧化还原反应,属于复分解反应,不能设计成原电池;
(B)中反应前后Fe元素化合价由+3价变为+2价、Cu元素化合价由0价变为+2价,所以有电子转移,能设计成原电池,
故答案为:(1)不能,(B)可以;
(2)根据(1)知,(A)的反应非氧化还原反应,没有电子转移,所以(A)不能设计成原电池,
故答案为:(A)的反应非氧化还原反应,没有电子转移;
(3)原电池反应中,化合价升高的金属单质作负极,不如负极活泼的金属或导电的非金属作正极,得电子化合价降低的电解质溶液作该原电池电解质溶液,Fe元素化合价由+3价变为+2价、Cu元素化合价由0价变为+2价,根据元素化合价变化知,Cu作负极、不如铜活泼的金属或导电的非金属作正极,如碳棒,氯化铁溶液为电解质溶液,负极反应式、正极反应式分别为Cu-2e-=Cu2+、2Fe3++2e-=2Fe2+,
故答案为:负极:铜,Cu-2e-=Cu2+;正极:碳棒,2Fe3++2e-=2Fe2+;氯化铁溶液.
点评 本题考查原电池设计,侧重考查学生实验设计及原电池原理,知道原电池正负极及电解质溶液的判断方法,知道元素化合价升降与正负极材料的关系,题目难度不大.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
2.按下列路线制聚氯乙烯,未发生的反应类型是( )
C2H5Br→CH2=CH2→C1H2C-CH2Cl→CH2=CHCl→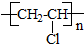
C2H5Br→CH2=CH2→C1H2C-CH2Cl→CH2=CHCl→
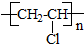
| A. | 消去反应 | B. | 取代反应 | C. | 加成反应 | D. | 加聚反应 |
3.草酸是二元弱酸,草酸氢钾溶液呈酸性.在0.1mol•L-1KHC2O4溶液中,下列关系正确的是( )
| A. | c(K+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-) | B. | c(HC2O4-)+c(C2O42-)=0.1mol•L-1 | ||
| C. | c(C2O42-)>c(H2C2O4) | D. | c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-) |
20.下列与有关非金属元素叙述以及推理结果不正确的是( )
| A. | 非金属性Cl>Br,故将Cl2通入NaBr溶液中,发生反应为:Cl2+2Br-=Br2+2Cl- | |
| B. | 非金属性F>Br,故酸性:HF>HBr | |
| C. | 非金属性S>33As,故前者的气态氢化物稳定性更强 | |
| D. | 非金属性O>N,故O2与H2化合比N2更容易 |
7.X和Y属短周期元素,X原子的最外层电子数是次外层电子数的一半,Y位于X的前一周期,且最外层只有一个电子,下列的说法正确的是( )
| A. | X可能是第二周期非金属元素 | B. | Y可能与X同主族 | ||
| C. | X可能是第三周期金属元素 | D. | Y一定是金属元素 |
17.下列有关物质结构的表述正确的是( )
| A. | H2O2的电子式: | B. | CO2的比例模型: | ||
| C. | 14C的原子结构示意图: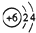 | D. | CCl4的结构式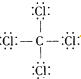 |
4.下列物质中,既含有极性键又含有非极性键的离子化合物是( )
| A. | Na2S2O8 | B. | NH4HCO3 | C. | H2O2 | D. | NaOH |
1.化学在生产和生活中有重要的应用.下列说法正确的是( )
| A. | 次氯酸钠是漂粉精的主要成分 | |
| B. | 氧化钠可用于呼吸面具 | |
| C. | 凡含有添加剂的食物对人体健康均有害,不宜食用 | |
| D. | “开发利用新能源”、“汽车尾气催化净化”都能提高空气质量 |