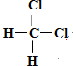题目内容
13.足量锌分别与体积相等、等pH的稀硫酸和醋酸溶液反应,其它条件相同,则A.开始时锌与稀硫酸反应速率=锌与醋酸反应速率(填“>”“<”或“=”,下同)
B.在相同时间内锌与稀硫酸生成H2量<锌与醋酸生成H2量
C.最终锌与稀硫酸生成H2量<锌与醋酸生成H2量.
分析 醋酸为弱酸,等pH时,醋酸浓度较大,与锌反应时,因开始时pH相等,则反应速率相等,随着反应的进行,醋酸不断电离,氢离子浓度大于硫酸溶液,则醋酸反应速率较大,最终醋酸生成氢气较多,以此解答该题.
解答 解:醋酸为弱酸,等pH时,醋酸浓度较大,
(1)pH相同,c(H+)相同,所以刚开始反应时的反应速率相等,故答案为:=;
(2)随着反应的进行,醋酸不断电离,氢离子浓度大于硫酸溶液,则醋酸反应速率较大,在相同时间内锌与稀硫酸生成H2量小于锌与醋酸生成H2量,故答案为:<;
(3)c(H+)相同的硫酸和醋酸溶液中醋酸的物质的量大于硫酸的物质的量,所以相同状况下醋酸产生氢气的量多,故答案为:<.
点评 本题考查弱电解质的电离,为高频考点,侧重于学生的分析能力的考查,注意把握弱电解质的电离特点、规律和应用,注重基础知识的学习和积累,难度不大.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案
相关题目
4.${\;}_{27}^{60}$Co是γ放射源,${\;}_{27}^{60}$Co可用于农作物的诱变育种,我国用该方法培育出了许多农作物新品种.对原子的叙述不正确的是( )
| A. | 质量数是60 | B. | 质子数是 27 | C. | 中子数是33 | D. | 电子数是33 |
5.下列各表中的数字代表的是原子序数,表中数字所表示的元素与它们在元素周期表中的位置相符的是( )
| A. |
| B. |
| C. |
| D. |
|
2.下列有关环境保护的说法中不正确的是( )
| A. | 含氮、磷化合物的生活污水大量排放可使水体富营养化 | |
| B. | 各国大量排放SO2是全球气候变暖的主要原因 | |
| C. | 发展低碳经济、循环经济,推广利用太阳能、风能的城市照明系统 | |
| D. | 废旧电池中的汞、镉、铅等重金属对土壤和水源会造成污染 |
3.仅改变下列一个条件,通过提高活化分子的百分率来提高反应速率的是( )
| A. | 加热 | B. | 加压 | C. | 加负催化剂 | D. | 加大反应物浓度 |
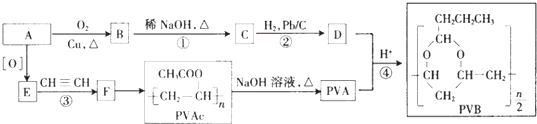
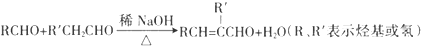
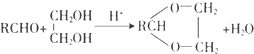
 .
.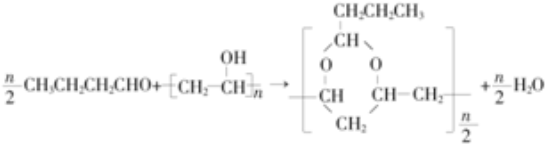 .
.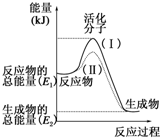 请认真观察如图,然后回答问题.
请认真观察如图,然后回答问题.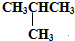 E.
E.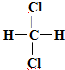 和
和