题目内容
7.X和Y属短周期元素,X原子的最外层电子数是次外层电子数的一半,Y位于X的前一周期,且最外层只有一个电子,下列的说法正确的是( )| A. | X可能是第二周期非金属元素 | B. | Y可能与X同主族 | ||
| C. | X可能是第三周期金属元素 | D. | Y一定是金属元素 |
分析 X原子的最外层电子数是次外层电子数的一半,则X可能为Li,也可能为Si,Y位于X的前一周期,且最外层上只有一个电子,则Y可能为H,也可能为Li,以此解答该题.
解答 解:X原子的最外层电子数是次外层电子数的一半,则X可能为Li,也可能为Si,Y位于X的前一周期,且最外层上只有一个电子,则Y可能为H,也可能为Li,则
A.X可能为Li,为第二周期金属元素,故A错误;
B.当X为Li,Y为H时,二者位于同主族,故B正确;
C.X也可能为Si,是第三周期的非金属元素,故C错误;
D.Y可能为H,也可能为Li,可能是金属元素,也可能为非金属元素,故D错误.故选B.
点评 本题考查元素的推断,题目难度不大,本题关键是根据原子的结构特点结合在周期表中的位置解答,解答时注意元素的种类.

练习册系列答案
相关题目
17.下列有关晶体的说法中正确的是( )
| A. | 氯化钾溶于水时离子键未被破坏 | B. | 原子晶体中共价键越强,熔点越高 | ||
| C. | 冰融化时分子中共价键发生断裂 | D. | 分子间作用力越大,分子越稳定 |
18.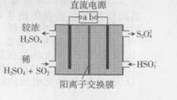 利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2,下列叙述错误的是( )
利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2,下列叙述错误的是( )
 利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2,下列叙述错误的是( )
利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2,下列叙述错误的是( )| A. | a为直流电源的正极 | |
| B. | 阴极的电极反应式为:2HSO3-+e-=S2O42-+H2O | |
| C. | 阳极的电极反应式为:SO2+2H2O-2e-=SO42-+4H+ | |
| D. | 电解时,H+由阳极室通过阳离子交换膜到达阴极室 |
2.关于如图所示装置(假设溶液体积不变),下列叙述正确的是( )
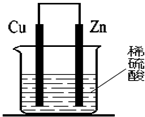

| A. | 电子从大量产生气泡的一极流出 | |
| B. | 反应一段时间后,溶液逐渐变为蓝色 | |
| C. | 逐渐溶解的一极上发生还原反应 | |
| D. | 烧杯内溶液中阳离子的物质的量浓度总和逐渐减小 |
19.下列实验不能达到目的是( )
| A. | 用KSCN溶液检验Fe2+ | B. | 用湿润的红色石蕊试纸检验氨气 | ||
| C. | 用湿润的淀粉碘化钾试纸检验氯气 | D. | 用硝酸酸化的AgNO3溶液检验Cl- |
16.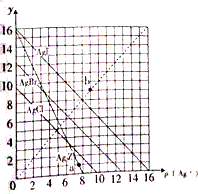 卤化银AgX及Ag2Z的沉淀溶解平衡曲线如图所示,已知横坐标p(Ag+)=-lgc(Ag+),纵坐标y=-lgc(X-)或-lgc(Z2-).下列说法正确的是( )
卤化银AgX及Ag2Z的沉淀溶解平衡曲线如图所示,已知横坐标p(Ag+)=-lgc(Ag+),纵坐标y=-lgc(X-)或-lgc(Z2-).下列说法正确的是( )
 卤化银AgX及Ag2Z的沉淀溶解平衡曲线如图所示,已知横坐标p(Ag+)=-lgc(Ag+),纵坐标y=-lgc(X-)或-lgc(Z2-).下列说法正确的是( )
卤化银AgX及Ag2Z的沉淀溶解平衡曲线如图所示,已知横坐标p(Ag+)=-lgc(Ag+),纵坐标y=-lgc(X-)或-lgc(Z2-).下列说法正确的是( )| A. | 该温度下Ag2Z的Ksp约为1×10-8 | |
| B. | a点可表示AgCl的过饱和溶液 | |
| C. | b点可表示AgI的过饱和溶液,且c(Ag+)=c(I-) | |
| D. | 该温度下AgCl、AgBr形成的混合溶液的饱和溶液中:c(Cl-)<c(Br-) |
 请认真观察如图,然后回答问题.
请认真观察如图,然后回答问题.