题目内容
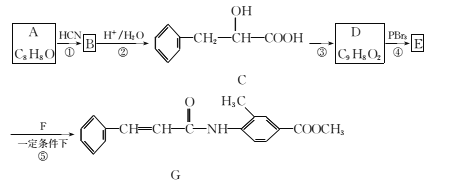
【题目】常温下,Ka(CH3COOH)=1.8×10-5,分别向20 mL 0.1 mol/L NaHCO3溶液和CH3COOH溶液中逐滴加入0.1 mol/L NaOH溶液,滴定曲线如图所示。下列叙述正确的是
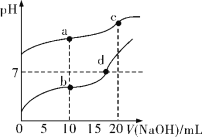
A.b点溶液中粒子浓度大小关系:c(CH3COO-)>c(Na+)>c(H+)>c(CH3COOH)>c(OH-)
B.c点溶液中存在:c(H+)+c(HCO3-)+2c(H2CO3)=c(OH-)
C.溶液中由水电离出c(H+)大小关系:b<d<a=c
D.d点溶液中: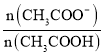 =180
=180
【答案】BD
【解析】
A. b点是20 mL 0.1 mol/L CH3COOH溶液中滴入10 mL0.1 mol/L氢氧化钠溶液发生反应生成的CH3COONa和过量CH3COOH等浓度的混合溶液,此时溶液pH<7,则c(H+)>c(OH-),说明CH3COOH的电离作用大于CH3COONa的水解作用,所以c(CH3COO-)>c(Na+),盐电离产生的Na+浓度远大于弱酸CH3COOH电离产生的H+的浓度,但酸电离程度是微弱的,主要以电解质分子存在,所以c(CH3COOH)>c(H+),醋酸分子发生电离而消耗,所以c(Na+)> c(CH3COOH)>c(H+),故溶液中微粒浓度大小关系为c(CH3COO-)>c(Na+)> c(CH3COOH)>c(H+)>c(OH-),A错误;
B. c点是20 mL 0.1 mol/L NaHCO3溶液中滴入20 mL0.1 mol/L氢氧化钠溶液发生反应生成的碳酸钠溶液,溶液中存在质子守恒,水电离出氢氧根离子浓度等于所有氢离子浓度总和,c(H+)+c(HCO3-)+2c(H2CO3)=c(OH-),B正确;
C. a点是Na2CO3、NaHCO3等浓度的混合溶液,促进水的电离;b点是等浓度CH3COONa和CH3COOH混合溶液,溶液的pH<7,说明醋酸电离作用大于CH3COONa的水解作用,水电离平衡受到抑制作用;c点是Na2CO3溶液,该盐是强碱弱酸盐,水解使溶液显碱性,促进水的电离;d点是pH等于7的CH3COONa和CH3COOH混合的中性溶液,水的电离平衡的抑制作用与促进作用相等,对水电离平衡移动无影响,根据溶液pH大小可知,四点水电离程度:b<d<a<c,水电离程度越大,水电离产生的c(H+)就越大,故溶液中由水电离出c(H+)关系为:b<d<a<c,C错误;
D. d点溶液pH=7为中性,c(H+)=c(OH-)=10-7 mol/L, ×
×![]() =
=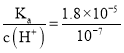 =180,D正确;
=180,D正确;
故答案选BD。

 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案【题目】开发新型储氢材料是开发利用氢能的重要研究方向。
(1)![]() 是一种储氢材料,可由
是一种储氢材料,可由![]() 和
和![]() 反应制得。
反应制得。
①基态Cl原子中,电子占据的最高电子层符号为 _______,该电子层具有的原子轨道数为 _______。
②Li、B、H元素的电负性由大到小的排列顺序为 ___________。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+ ___________(填“>”“=”或“<”)H-。
②某储氢材料是短周期金属元素M的氢化物。M的部分电离能如表所示:
|
|
|
|
|
738 | 1451 | 7733 | 10540 | 13630 |
则M是 ______________ (填元素符号)。
【题目】下表是元素周期表的一部分,表中的字母分别代表一种化学元素。

(1)上述元素中,原子中未成对电子数最多的是 ___________ (填字母),写出该元素基态原子的核外电子排布式: ___________ 。
(2)根据下表所提供的电离能数据,回答下列问题。
锂 | X | Y | |
I1 | 520 | 496 | 580 |
I2 | 7296 | 4562 | 1820 |
I3 | 11799 | 6912 | 2750 |
I4 | 9543 | 11600 |
①表中X可能为以上13种元素中的 _____________ (填字母)元素。用元素符号表示X和j形成的一种化合物的化学式: _____________ 。
②Y是周期表中第 _____________ 族元素。
【题目】类推的思维方法在化学学习与研究中常会产生错误的结论,因此类推的结论最终要经过实践的检验才能确定其正确与否。下表中有关推论正确的是( )
已知事实 | 推论 | |
A | 氯乙烷能发生消去反应 | 所有的卤代烃都能发生消去反应 |
B | 乙烯分子内所有原子在同一平面上 | 丙烯分子内所有原子在同一平面上 |
C | 乙烯在空气中燃烧有黑烟 | 苯在空气中燃烧产生的烟更浓 |
D | 烷烃的含碳量随碳原子数的增大而增大 | 炔烃的含碳量随碳原子数的增大而增大 |
A.AB.BC.CD.D