题目内容
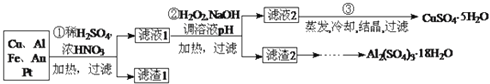
【题目】信息时代产生的大量电子垃圾对环境造成了极大的威胁.某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含![]() 、
、![]() 、
、![]() 及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:
及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:
回答下列问题:
![]() 第
第![]() 步Cu与酸反应的离子方程式为 ______ ;得到滤渣1的主要成分为 ______ .
步Cu与酸反应的离子方程式为 ______ ;得到滤渣1的主要成分为 ______ .
![]() 第
第![]() 步加入
步加入![]() 的作用是 ______ ,使用
的作用是 ______ ,使用![]() 的优点是 ______ ;调节pH的目的是使 ______ 生成沉淀.
的优点是 ______ ;调节pH的目的是使 ______ 生成沉淀.
![]() 由滤渣2制取
由滤渣2制取![]() ,探究小组设计了三种方案:
,探究小组设计了三种方案:
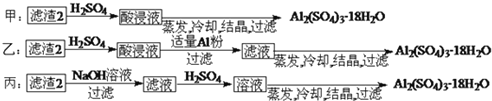
上述三种方案中, ______ 方案不可行,原因是 ______ ;
![]() 探究小组用滴定法测定
探究小组用滴定法测定![]() 含量.取ag试样配成100mL溶液,每次取
含量.取ag试样配成100mL溶液,每次取![]() ,消除干扰离子后,用c
,消除干扰离子后,用c![]()
![]() 标准溶液滴定至终点,平均消耗EDTA溶液b
标准溶液滴定至终点,平均消耗EDTA溶液b![]() 滴定反应如下:
滴定反应如下:![]() 写出计算
写出计算![]() 质量分数的表达式
质量分数的表达式![]() ______ .
______ .
【答案】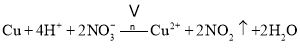 Au、Pt 把
Au、Pt 把![]() 氧化为
氧化为![]() 不引入杂质,产物对环境无污染
不引入杂质,产物对环境无污染 ![]() 、
、![]() 甲 滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质
甲 滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质 ![]()
【解析】
金属的混合物与稀硫酸、浓硝酸混合后加热,Cu、Al、Fe发生反应生成Cu2+、Al3+、Fe2+,而Au、Pt不反应,所以滤渣1 的成分是Pt和Au,滤液1中的离子是Cu2+、Al3+、Fe2+、Fe3+,第②步加H2O2的作用是把Fe2+氧化为Fe3+,该氧化剂的优点是不引入杂质,产物对环境物污染,调溶液PH的目的是使Fe3+和Al3+形成沉淀.所以滤液2的成分是Cu2+,经蒸发结晶可得到CuSO45H2O晶体,滤渣2的成分为氢氧化铁和氢氧化铝,在滤渣中加NaOH,和Al(OH)3反应生成NaAlO2,再在滤液中加H2SO4生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体。
![]() 稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成
稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成![]() 、
、![]() 、
、![]() ;所以滤渣1的成分是Pt和Au,滤液1中的离子是
;所以滤渣1的成分是Pt和Au,滤液1中的离子是![]() 、
、![]() 、
、![]() ;第
;第![]() 步Cu与酸反应的离子方程式为:
步Cu与酸反应的离子方程式为: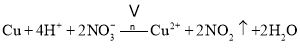 ,Au、Pt和酸不反应,所以是滤渣;
,Au、Pt和酸不反应,所以是滤渣;
故答案为: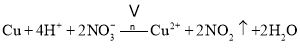 ,Au、Pt;
,Au、Pt;
![]() 第
第![]() 步加
步加![]() 的作用是将
的作用是将![]() 氧化为
氧化为![]() ,过氧化氢做氧化剂不引入杂质,对环境无污染,调节溶液PH铁离子和铝离子全部沉淀后过滤得到氢氧化铁、氢氧化铝沉淀和滤液硫酸铜,故答案为:将
,过氧化氢做氧化剂不引入杂质,对环境无污染,调节溶液PH铁离子和铝离子全部沉淀后过滤得到氢氧化铁、氢氧化铝沉淀和滤液硫酸铜,故答案为:将![]() 氧化为
氧化为![]() ,不引入杂质,产物对环境无污染,
,不引入杂质,产物对环境无污染,![]() 、
、![]() 生成沉淀;
生成沉淀;
![]() 制备硫酸铝晶体的甲、乙、丙三种方法中,甲方案在滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质,方法不可行,故答案为:甲,滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质;
制备硫酸铝晶体的甲、乙、丙三种方法中,甲方案在滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质,方法不可行,故答案为:甲,滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质;
![]() 取
取![]() 试样配成100mL溶液,每次取
试样配成100mL溶液,每次取![]() ,消除干扰离子后,用
,消除干扰离子后,用![]() 标准溶液滴定至终点,平均消耗EDTA溶液
标准溶液滴定至终点,平均消耗EDTA溶液![]() 滴定反应如下:
滴定反应如下:![]() 铜离子物质的量和标准液物质的量相同
铜离子物质的量和标准液物质的量相同![]() ;依据元素守恒得到:
;依据元素守恒得到:
则20ml溶液中含有的![]() 物质的量为
物质的量为![]() ;100ml溶液中含
;100ml溶液中含![]() ;
;
所以![]() 质量分数的表达式
质量分数的表达式![]() ;故答案为:
;故答案为:![]() .
.

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案