题目内容
【题目】某学生欲完成反应2HCl+2Ag![]() 2AgCl↓+H2↑而设计了下列四个实验,你认为可行的是( )
2AgCl↓+H2↑而设计了下列四个实验,你认为可行的是( )
A.  B.
B.  C.
C.  D.
D. 
【答案】C
【解析】试题分析:该反应不能自发进行,要使该反应发生,则只能设计成电解池,Ag失电子化合价升高,应该作阳极,其它金属或导电的非金属作阴极,A.要实现该反应2HCl+2Ag═2AgCl↓+H2↑,该装置中应该Ag作阳极、C作阴极,A错误;B.该装置是原电池不是电解池,且发生反应Fe+2HCl=FeCl2+H2↑,B错误;C.该装置是电解池,且Ag作阳极、Ag作阴极,能完成反应2HCl+2Ag═2AgCl↓+H2↑,C正确;D.该装置既不是原电池也不是电解池,Ag和HCl不反应,所以不能完成反应2HCl+2Ag═2AgCl↓+H2↑,D错误,答案选C。

 名校课堂系列答案
名校课堂系列答案【题目】TiC14是制备钛及其化合物的重要中间体,某小组同学利用下列装置在实验室制备TiCl4,设计实验如下(夹持装置略去):
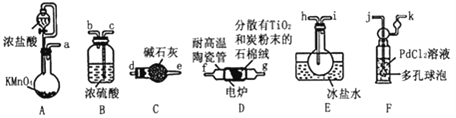
已知:
①PdC12溶液捕获CO时,生成金属单质和两种酸性气体化合物。
②TiC14的制备需无水无氧且加热。
③
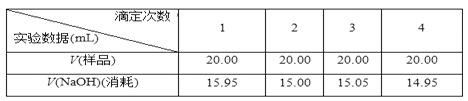
化合物 | 熔点/℃ | 沸点/℃ | 密度/gcm-3 | 水溶性 |
TiCl4 | -25 | 136.4 | 1.5 | 易水解生成难溶于水的物质,能溶于有机溶剂 |
CCl4 | -23 | 76.8 | 1.6 | 难溶于水,与TiCl4互溶 |
请回答下列问题:
(1)装置D中除生成TiCl4外,同时生成一种气态不成盐氧化物,该反应的化学方程式为__________________。
(2)按照气流由左到右的方向,上述装置合理的连接顺序为a→____→____→f→g→___→____→_____→_____→_____(填仪器接口字母)。
(3)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;_____________(按正确的顺序填入下列操作的序号)。
①加热装置D中陶瓷管 ②打开分液漏斗活塞
③停止加热,充分冷却 ④关闭分液漏斗活塞
实验时,当观察到____________________________时,开始进行步骤①。
(4)设计实验证明装置E中收集到的液体中含有TiCl4:___________。
(5)装置F中发生反应的化学方程式为____________________。
(6)制得的TiC14产品中常含有少量CC14,从产品中分离出TiC14的操作名称为_____________________________。
【题目】为探究Na 与CO2反应产物,某化学兴趣小组按下图装置进行实验。
已知:CO + 2Ag ( NH3) 2OH=2Ag↓+( NH4 ) 2CO3 +2NH3

回答下列问题:
(1)写出A 中反应的离子方程式__________________________。
(2)仪器X 的名称是_____________,B 中的溶液为________________。
(3)先称量硬质玻璃管的质量为m1 g ,将样品装入硬质玻璃管中,称得样品和硬质玻璃管的总质量是m2 g 。再进行下列实验操作,其正确顺序是________(填标号);
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,通入CO2至E 中出现浑浊
e.称量硬质玻璃管 f.冷却到室温
重复上述操作步骤,直至硬质玻璃管恒重,称得质量为m3 g 。
(4)加热硬质玻璃管一段时间,观察到以下现象
① 钠块表面变黑,熔融成金属小球;
② 继续加热,钠迅速燃烧,产生黄色火焰。反应完全后,管中有大量黑色物质;③ F 中试管内壁有银白物质产生。
产生上述②现象的原因是____________________________________。
(5)探究固体产物中元素Na 的存在形式
假设一:只有Na2CO3;假设二:只有Na2O ;假设三:Na2O和Na2CO3均有
完成下列实验设计,验证上述假设:
步骤 | 操作 | 结论 |
1 | 将硬质玻璃管中的固体产物溶于水后过滤 | 假设一成立 |
2 | 往步骤1所得滤液中___________________________ | |
3 | _____________________________________________ |
(6)根据上述实验现象及下表实验数据,写出Na 与CO2反应的总化学方程式___________。
m1 | m2 | m3 |
66.7g | 69.0g | 72.1g |