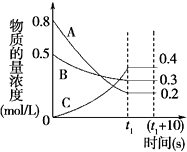
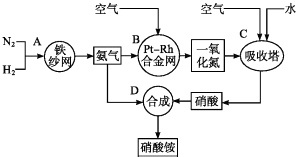
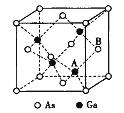
题目内容
【题目】a mol Fe3O4与b mol FeO投入V L c mol·L-1的HNO3溶液(过量)中,充分反应,产生气体为NO,则反应后溶液中NO3-的量为
A. 62(a+b) g B. 186(a+b) g
C. ![]() mol D.
mol D. ![]() mol
mol
【答案】C
【解析】a mol Fe3O4与b mol FeO投入V L c mol·L-1的HNO3溶液(过量)中,因为硝酸过量,所以溶液中最后剩余的硝酸根可以认为是:用原溶液中的总硝酸根减去转化为NO气体离开溶液的硝酸根即可。原溶液有cV mol硝酸,也有同样多的硝酸根。反应中铁应该都转化为+3价,其中1个Fe3O4中有3个+8/3价铁升高到+3价,所以1个Fe3O4失去3×1/3=1个电子,a mol Fe3O4失去a mol电子,1个FeO中有1个+2价铁升高到+3价,所以1个FeO失去1个电子,b mol FeO失去b mol电子,则一共失去(a+b)mol电子。根据得失电子守恒,硝酸应该得到(a+b)mol电子。每个硝酸应该得到3个电子生成1个NO,所以NO为(a+b)/3 mol,所以溶液中剩余的硝酸为![]() mol。选项C正确。
mol。选项C正确。

练习册系列答案
 一课一练课时达标系列答案
一课一练课时达标系列答案 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目