题目内容
2.(1)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.8kJ的热量(相当于25℃、101kPa下测得的热量).①反应的热化学方程式为N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-642kJ/mol.
②又已知H2O(l)═H2O(g)△H=+44kJ/mol.则16g液态肼与液态双氧水反应生成液态水时放出的热量是409kJ.
③此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是产物不会造成环境污染.
(2)已知热化学方程式:①Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-25kJ•mol-1
②3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=-47kJ•mol-1
③Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=19kJ•mol-1
写出FeO(s)被CO还原生成Fe和CO2的热化学方程式:FeO(s)+CO(g)═Fe(s)+CO2(g)△H=-11 kJ•mol-1.
(3)已知反应2HI(g)═H2(g)+I2(g)的△H=+11kJ•mol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436KJ、151KJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为299kJ.
分析 (1)①依据反应物和生成物配平书写化学方程式,根据定律关系判断,0.4mol液态肼和0.8mol H2O2混合恰好反应,所以1mol液态肼完全反应放出641.75kJ的热量;
②H2O(l)=H2O(g)△H=+44kJ/mol;依据盖斯定律计算分析得到;
③依据产物判断生成物质无污染;
(2)依据盖斯定律结合热化学方程式计算,然后写出热化学方程式;
(3)正反应为吸热反应,化学键断裂时需吸收的能量-化学键生成时需放出的能量=反应吸收的热量.
解答 解:(1)①反应方程式为:N2H4+2H2O2=N2+4H2O,0.4mol液态肼放出256.8KJ的热量,则1mol液态肼放出的热量为$\frac{256.8kJ}{0.4}$=642kJ,
所以反应的热化学方程式为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-642kJ/mol,
故答案为:N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=-642kJ/mol;
②N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-642kJ/mol①;H2O(l)=H2O(g)△H=+44kJ/mol②;依据盖斯定律①-②×4得到N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-818KJ/mol:则16g液态肼物质的量=$\frac{16g}{32g/mol}$=0.5mol;与液态双氧水反应生成液态水时放出的热量409kJ;
故答案为:409;
③此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是产物为氮气和水,是空气成分不会造成环境污染;
故答案为:产物不会造成环境污染;
(2)①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g);△H=-25kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g);△H=-47kJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g);△H=+19kJ/mol
依据盖斯定律①×3-(③×2+②)得到:
6CO(g)+6FeO(s)=6Fe(g)+6CO2(g)△H=-66KJ/mol;
得到热化学方程式为:CO(g)+FeO(s)=Fe(g)+CO2(g)△H=-11KJ/mol,
故答案为:CO(g)+FeO(s)=Fe(g)+CO2(g)△H=-11KJ/mol;
(3)设1molHI(g)分子中化学键断裂时需吸收的能量为x kJ,则:2x kJ-436kJ-151kJ=11kJ,解得x=299,
故答案为:299kJ.
点评 本题考查热化学方程式的书写,盖斯定律的计算判断,反应热的计算应用,注意盖斯定律的应用,题目难度中等.

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案| 化合物 | 甲 | 乙 | 丙 | 丁 | 戊 | 己 |
| 化学式 | A2C | A2C2 | B2A4 | D2C2 | A2E | DF |
(1)元素E在周期表中的位置第3周期第VIA族化合物丙的结构式为
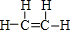 ,化合物甲的稳定性比戊高(填“高”或“低”) 化合物丁的化学键类型是离子键、共价键
,化合物甲的稳定性比戊高(填“高”或“低”) 化合物丁的化学键类型是离子键、共价键(2)用电子式表示己的形成过程:

(3)单质B与浓硝酸发生化学反应的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O
(4)向含有0.2mol乙的水溶液中加入少量MnO2,使乙完全反应,发生转移的电子数为0.2 NA(NA代表阿伏加德罗常数)
| A. | 汽油燃料电池的能量转化率比汽油在发动机中燃烧产生动力的能量转化率高 | |
| B. | 通入的空气为阳极,电极反应为O2+4e-═2O2- | |
| C. | 负极的电极反应为:C4H10-26e-+13O2-═4CO2+5H2O | |
| D. | 该电池可能出现气体通道被堵塞的问题 |