题目内容
1.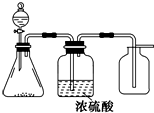 如图是一套实验室制气装置,用于制取、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是( )
如图是一套实验室制气装置,用于制取、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是( )| A. | 碱石灰和浓氨水 | B. | 锌和稀硫酸 | C. | 碳酸钙和稀盐酸 | D. | 铜和稀硝酸 |
分析 由装置图可知,反应为液体和固体的反应,且不需要加热,生成的气体可用浓硫酸干燥,且能用向上排空法收集,说明气体的密度比空气大,不与空气中氧气发生反应,
A.氨气能够与硫酸反应,不能用浓硫酸干燥,且应该用向下排空气法收集;
B.氢气密度小于空气,应该用向下排空气法收集;
C.二氧化碳密度大于空气,能够用浓硫酸干燥;
D.一氧化氮与空气中氧气反应,不能使用排空气法收集.
解答 解:A.氨气密度比空气小,应用向下排空法收集,且不能用浓硫酸干燥,故A错误;
B.锌与稀硫酸反应生成氢气,氢气密度小于空气,应该采用向下排空气法收集,故B错误;
C.碳酸钙和稀盐酸反应生成二氧化碳,二氧化碳密度比空气大,可用向上排空法收集,故C正确;
D.铜和稀硝酸反应生成的NO密度和空气非常接近,难溶于水,与空气中的氧气反应,应用排水法收集,故D错误;
故选C.
点评 本题考查了化学实验装置的应用,题目难度中等,为高频考点,注意把握物质的性质,根据物质的性质判断装置的要求,试题侧重于学生的分析能力和实验能力的考查.

练习册系列答案
相关题目
11.下列说法正确的是( )
| A. | NH3的水溶液能导电,所以NH3是电解质 | |
| B. | BaSO4其水溶液几乎不导电,但BaSO4是电解质 | |
| C. | 液溴不导电,所以液溴是非电解质 | |
| D. | 食盐水能导电,故其属于电解质 |
9.某醇被氧化后的产物为酮(C5H10O),则该醇的结构简式可能是( )
| A. | (CH3)3CCH2OH | B. | (CH3CH2)2CHOH | C. | CH3(CH2)3CH2OH | D. | CH3CH2C(CH3)2OH |
16.下列反应中,生成物的总能量大于反应物的总能量的是( )
| A. | 甲烷在空气气中燃烧 | B. | 碳酸钙高温分解 | ||
| C. | 氧化钙溶于水 | D. | 铁丝在氧气中燃烧 |
13.A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大.A与D同主族;C与E同主族;B、C同周期;B原子最外层电子数比其次外层电子数多2;B、A两元素的核电荷数之差等于它们的原子最外层电子数之和;F元素是同周期元素中原子半径最小的主族元素.A、B、C、D、E、F形成的化合物甲、乙、丙、丁、戊、己的组成如下表所示.
回答下列问题:
(1)元素E在周期表中的位置第3周期第VIA族化合物丙的结构式为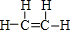 ,化合物甲的稳定性比戊高(填“高”或“低”) 化合物丁的化学键类型是离子键、共价键
,化合物甲的稳定性比戊高(填“高”或“低”) 化合物丁的化学键类型是离子键、共价键
(2)用电子式表示己的形成过程:
(3)单质B与浓硝酸发生化学反应的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O
(4)向含有0.2mol乙的水溶液中加入少量MnO2,使乙完全反应,发生转移的电子数为0.2 NA(NA代表阿伏加德罗常数)
| 化合物 | 甲 | 乙 | 丙 | 丁 | 戊 | 己 |
| 化学式 | A2C | A2C2 | B2A4 | D2C2 | A2E | DF |
(1)元素E在周期表中的位置第3周期第VIA族化合物丙的结构式为
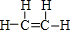 ,化合物甲的稳定性比戊高(填“高”或“低”) 化合物丁的化学键类型是离子键、共价键
,化合物甲的稳定性比戊高(填“高”或“低”) 化合物丁的化学键类型是离子键、共价键(2)用电子式表示己的形成过程:

(3)单质B与浓硝酸发生化学反应的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O
(4)向含有0.2mol乙的水溶液中加入少量MnO2,使乙完全反应,发生转移的电子数为0.2 NA(NA代表阿伏加德罗常数)
11.为了贯彻“绿色环保”理念,某汽车尾气研究小组根据汽油(用C4H10表示)燃料电池的工作原理(一个电极通入空气,另一电极通入汽油蒸气,掺杂了Y2O3、ZrO2晶体作电解质,其在高温下传导O2-)设计汽油燃料电池,从而减少废气的排放.下列说法错误的是( )
| A. | 汽油燃料电池的能量转化率比汽油在发动机中燃烧产生动力的能量转化率高 | |
| B. | 通入的空气为阳极,电极反应为O2+4e-═2O2- | |
| C. | 负极的电极反应为:C4H10-26e-+13O2-═4CO2+5H2O | |
| D. | 该电池可能出现气体通道被堵塞的问题 |
