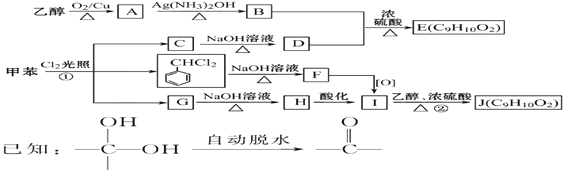
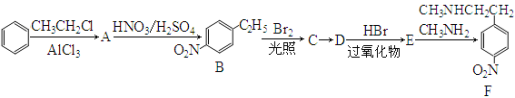
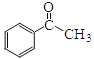
题目内容
【题目】运载火箭常用偏二甲肼(C2H8N2)(其中N的化合价为-3)作燃料和四氧化二氮(N2O4)反应。在火箭升空过程中,燃料发生反应:C2H8N2+2N2O4![]() 2CO2+3N2+4H2O提供能量。下列有关叙述正确的是
2CO2+3N2+4H2O提供能量。下列有关叙述正确的是
A. 该燃料绿色环保,在燃烧过程中不会造成任何环境污染
B. 该反应中N2O4是氧化剂,偏二甲肼是还原剂
C. N2既是氧化产物又是还原产物,CO2既不是氧化产物也不是还原产物
D. 每有0.6 mol N2生成,转移电子数目为2.4NA
【答案】B
【解析】
试题A、四氧化二氮可污染环境,故A错误;B、偏二甲肼中碳元素化合价从-1价升高到+4价,氮元素从-3价升高到0价,做还原剂,故B正确;C、碳元素化合价升高,则二氧化碳为氧化产物,故C错误;D、由方程式分析,每由0.6摩尔氮气生成,则消耗0.4摩尔四氧化二氮,则转移电子的物质的量为0.4×4×2=3.2摩尔,则每由0.6摩尔氮气转移3.2摩尔电子,故D错误。

练习册系列答案
相关题目
【题目】下列各组物质能满足如图所示转化关系的是(图中箭头表示进一步转化)

a | b | c | d | |
① | Si | SiO2 | H2SiO3 | Na2SiO3 |
② | Al | AlCl3 | NaAlO2 | Al(OH)3 |
③ | Cu | CuO | Cu(OH)2 | CuSO4 |
④ | Fe2O3 | FeCl3 | FeCl2 | Fe |
A. ①② B. ②③ C. ③④ D. ②④