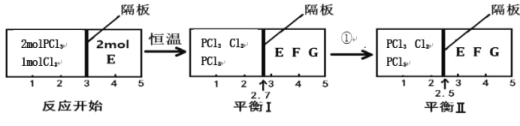
��Ŀ����
����Ŀ��[��ѧ��ѡ���л���ѧ����]
������F�Ǻϳɿ�����ʧ��ҩ��������ص��м������Ա�Ϊԭ�Ϻϳ�F��·������:
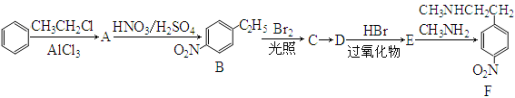
��֪����CH3CH=CH2![]() CH3CHBrCH3 ��CH3CH=CH2
CH3CHBrCH3 ��CH3CH=CH2![]() CH3CH2CH2Br
CH3CH2CH2Br
�Իش���������
��1������Aת���ķ�Ӧ������ ��
��2��������C��Dת���ķ�Ӧ����ͨ���� ��������D ������ڡ����������ڡ���˳���칹����֪������C�ĺ˴Ź���������ʾ�����ַ壬�ҷ�������Ϊ2�U2�U1�U3����C�Ľṹ��ʽΪ ��
��3��д��E��Fת���Ļ�ѧ����ʽ ��
��4������B��ͬ���칹���ж��֣���������������ͬ���칹�干�� �֡�
�����ڷ����廯����
�ڷ��ӽṹ��û�м������а���
���ܷ���������Ӧ��ˮ�ⷴӦ��������NaOH��Ӧ�����ʵ���֮��Ϊ1�U2
��5������ͪ��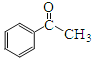 ���������л���ѧ�ϳɵ��м��壬���������ϳ�F�IJ��ֲ��裬���һ���Ա�Ϊ��ʼԭ���Ʊ�����ͪ�ĺϳ�·�� ��
���������л���ѧ�ϳɵ��м��壬���������ϳ�F�IJ��ֲ��裬���һ���Ա�Ϊ��ʼԭ���Ʊ�����ͪ�ĺϳ�·�� ��
���𰸡���1��ȡ����Ӧ
��2��NaOH����Һ������ ������ ![]()
��3��![]() ��CH3NH2
��CH3NH2![]() ��HBr
��HBr
��4��3
��5��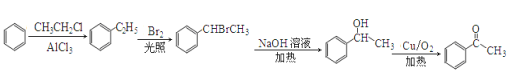
��������
�����������1������һ�����鷴Ӧ���ڱ����������һ���˵��Ϊȡ����Ӧ��
��2��C��D��±��������ȥ��Ӧ������ΪNaOH����Һ�ͼ��ȣ�������D������ϩ����������˳���칹��C�ĺ˴Ź���������ʾ�����ַ壬��˵����������ԭ�ӣ���ṹΪ![]() ��
��
��3��E��F�Ƿ�����ȡ����Ӧ������ʽΪ
![]() ��CH3NH2
��CH3NH2![]() ��HBr��
��HBr��
��4��������B��ͬ���칹��������Ҫ����ܷ���������Ӧ��ˮ�ⷴӦ��˵�����м������������������Ʒ�Ӧ�����ʵ�����Ϊ1:2������ˮ���������ǻ���˵���ṹ������������ ���ֱ�Ϊ-CH2NH2��-OOCH�����������ڱ����Ͽ������ڼ������λ�ù�ϵ��������3�ֽṹ��
��5�������Ʒ���������Ҫ�����ʻ�����Ҫ�ȳ����ǻ�������������Ӧ���ɣ����ǻ��ij�������±����ˮ�����ɵģ���±��������������±���ڹ��������·���ȡ����Ӧ�õ��ģ��������ڱ����������һ��������ұ������ڹ���������ȡ���м�̼ԭ���ϵ���ԭ�����ɴ������������ɣ��������£�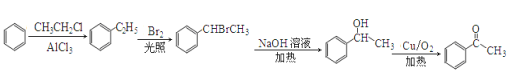 ��
��

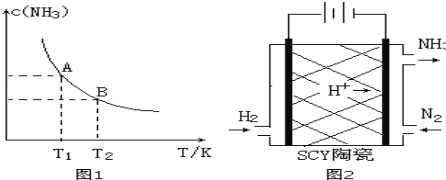
����Ŀ����1����һ�������£���1.00molN2��g����3.00molH2��g�������һ��10.0L�ܱ������У��ڲ�ͬ�¶��´ﵽƽ��ʱNH3��g����ƽ��Ũ����ͼ1��ʾ�������¶�ΪT1ʱƽ���������а������������Ϊ25.0%��
�����¶���T1�仯��T2ʱ��ƽ�ⳣ����ϵK1 K2�����������������=�������ʱ���H 0���������������
���÷�Ӧ��T1�¶���5.00min�ﵽƽ�⣬���ʱ����N2�Ļ�ѧ��Ӧ����Ϊ ��
��T1�¶��¸÷�Ӧ�Ļ�ѧƽ�ⳣ��K1= ��
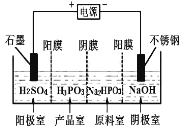
��2���������¡��˹��̵������о��������ڳ��³�ѹ����������N2�ڴ���������ˮ������Ӧ��2N2��g��+6H2O��l��=4NH3��g��+3O2��g�����˷�Ӧ����S 0�������������������֪��N2��g��+3H2��g��=2NH3��g����H=a kJ/mol 2H2��g��+O2��g��=2H2O��l����H=b kJ/mol 2N2��g��+6H2O��l��=4NH3��g��+3O2��g������H= ���ú�a��b��ʽ�ӱ�ʾ����
��3����ѧ�Ҳ������Ӹߵ����Ե�SCY�մɣ��ɴ���H+��ʵ���˵��³�ѹ�¸�ת���ʵĵ绯ѧ�ϳɰ�����ʵ��ԭ��ʾ��ͼ��ͼ2��ʾ���������ĵ缫��Ӧʽ�� ��
��4����֪ijЩ���������ˮ�еĵ���ƽ�ⳣ����25�������±���
������� | H2CO3 | NH3.H2O |
����ƽ�ⳣ�� | Ka1=4.30��10-7 Ka2=5.61��10-11 | Kb=1.77��10-5 |
���г�����0��1 mol��L-1�ģ�NH4��2CO3��Һ��
������Һ�� �ԣ���ᡱ�����С����������ԭ���� ��
���ã�NH4��2CO3��Һ�и���Ũ��֮��Ĺ�ϵʽ����ȷ���� ��
A��c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3.H2O)
B��c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C��c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol/L
D��c(NH4+)+c(NH3.H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
E��c(H+)+c(HCO3-)+c(H2CO3)=c(OH-)+c(NH3.H2O)