题目内容
20.为解决日益加剧的温室效应等问题,科学家正在研究建立如图所示的二氧化碳新循环体系:上述关系图能反映的化学观点或化学思想有( )①二氧化碳也是一种重要的资源;
②光能或电能可以转化为化学能;
③燃烧时化学能可以转化为热能和光能;
④无机物和有机物可以相互转化;
⑤化学变化中元素种类是守恒的.

| A. | ①②③ | B. | ①④⑤ | C. | ①②④⑤ | D. | ①②③④⑤ |
分析 二氧化碳的转化过程是一个复杂的过程,这一过程中发生的变化都是化学变化,所以满足质量守恒定律.同时在这些变化中化学能和动能、势能之间相互转化,有机物和无机物之间也能相互转化.理清图示中的各物质之间的转化关系,分析其中的变化过程.上图中的关键步骤是以水通电分解得到的氢气和二氧化碳为原料在复合催化剂的作用下转化为甲醇等能源,据此分析即可解答.
解答 解:①从图示中可以看出,二氧化碳和氢气在一定条件下可以转化为甲醇等能源,二氧化碳在很多工业和农业中有大量的应用,所以二氧化碳也是一种重要的资源,故①正确;
②水在光催化剂或电解生成氢气和氧气,体现了光能或电能可以转化为化学能,故②正确;
③液化石油气、汽油、甲醇的燃烧、无机物二氧化碳和氢气在复合催化剂的催化作用下可以转化为甲醇等有机物都说明燃烧时化学能可以转化为热能和光能,故③正确;
④液化石油气、汽油、甲醇转化为二氧化碳,无机物二氧化碳和氢气在复合催化剂的催化作用下可以转化为甲醇等有机物,说明无机物和有机物可以相互转化,故④正确;
⑤由图可知,混合气分离出二氧化碳,水分解生成氢气,二氧化碳和氢气在一定条件下可以转化为甲醇等能源都遵循化学变化中元素种类守恒的原则,故⑤正确;
故选D.
点评 本题以信息给予的形式考查了二氧化碳的相关问题,解题的关键是理清其中的转化关系,紧扣题干信息结合相关化学知识,题目难度中等.

练习册系列答案
相关题目
11.几种短周期元素的原子半径及主要化合价如下表:
下列叙述正确的是( )
| 元素代号 | X | Y | Z | W |
| 原子半径/nm | 0.186 | 0.160 | 0.102 | 0.074 |
| 主要化合价 | +1 | +2 | -2、+4、+6 | -2 |
| A. | X、Y元素的金属性X<Y | |
| B. | X和W能组成两种化合物 | |
| C. | Y和W属于同周期的元素 | |
| D. | Z和W属于同主族元素,其单质能直接化合生成ZW3 |
8.下列说法不正确的是( )
| A. | 棉花、蚕丝和锦纶的主要成分是纤维素 | |
| B. | 油脂在空气中完全燃烧生成二氧化碳和水 | |
| C. | 苯、乙醇和乙酸都能发生取代反应 | |
| D. | 淀粉和纤维素的组成通式为(C6H10O5)n,二者互为同分异构体 |
15.最近,意大利科学家使用普通氧分子和带正电荷的氧离子制造出了由4个氧原子构成的氧分子O4,并用质谱仪探测到了它是一种存在时间很短的化学物质.该氧分子具有空间对称结构,下列关于该氧分子的说法正确的是( )
| A. | 是一种新的化合物 | B. | 可能含有极性键 | ||
| C. | 在自然界中能稳定存在 | D. | 与O2互为同素异形体 |
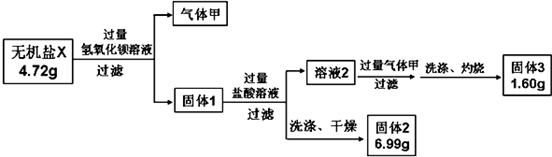
10.根据所学知识,完成下列问题:
(1)化学反应可视为旧键断裂和新键生成的过程.键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和其燃烧产物P4O6的分子结构如图1所示,现提供以下键能(kJ•mol-1):P-P:198,P-O:360,O-O:498,白磷(P4)燃烧的热化学方程式为P4(s,白鳞)+3O2(g)═P4O6(s)△H=-1638kJ•mol-1.
(2)化学能与电能之间可以相互转化,以Fe,Cu,C(石墨),CuSO4溶液、FeSO4溶液,Fe2(SO4)3溶液、AgNO3溶液为原料,通过原电池反应实现2Fe3++Cu═2Fe2++Cu2+.请你把图2补充完整,使之形成闭合电路,并用元素符号标明电极.电池中电解液时是CuSO4溶液;乙池中电解液是Fe2(SO4)3溶液.(要求:甲乙两池中电解质元素种类始终保持不变)
(3)某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物)其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
①对PM2.5空气样本用蒸馏水处理,制成待测试样.若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据判断该试样的酸碱性为酸性,试样的pH值=4
②已知气缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0
若1mol空气含有0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡.测得NO为8×10-4mol.计算该温度下的平衡常数K=4×10-6;汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是正反应为吸热反应,升高温度,反应速率加快,平衡右移.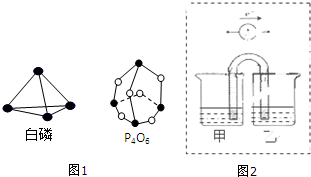
(1)化学反应可视为旧键断裂和新键生成的过程.键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和其燃烧产物P4O6的分子结构如图1所示,现提供以下键能(kJ•mol-1):P-P:198,P-O:360,O-O:498,白磷(P4)燃烧的热化学方程式为P4(s,白鳞)+3O2(g)═P4O6(s)△H=-1638kJ•mol-1.
(2)化学能与电能之间可以相互转化,以Fe,Cu,C(石墨),CuSO4溶液、FeSO4溶液,Fe2(SO4)3溶液、AgNO3溶液为原料,通过原电池反应实现2Fe3++Cu═2Fe2++Cu2+.请你把图2补充完整,使之形成闭合电路,并用元素符号标明电极.电池中电解液时是CuSO4溶液;乙池中电解液是Fe2(SO4)3溶液.(要求:甲乙两池中电解质元素种类始终保持不变)
(3)某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物)其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
①对PM2.5空气样本用蒸馏水处理,制成待测试样.若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
②已知气缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0
若1mol空气含有0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡.测得NO为8×10-4mol.计算该温度下的平衡常数K=4×10-6;汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是正反应为吸热反应,升高温度,反应速率加快,平衡右移.

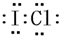 ,判断下列物质不能与B发生化学反应的有C
,判断下列物质不能与B发生化学反应的有C