题目内容
2.用NA表示阿伏加德罗常数的数值,下列说法正确的是( )| A. | 标准状况下,11.2LO2参加反应转移的电子数一定为2NA | |
| B. | 用双氧水分解制取0.1mol氧气,转移的电子总数为0.4×6.02×1023 | |
| C. | 0.1molAlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒 | |
| D. | 28gN2和CO的混合气体中含有的分子数为NA |
分析 A、氧气反应后的产物中,化合价有-1、-2价两种;
B、2H2O2$\frac{\underline{\;加热\;}}{\;}$2H2O+O2↑,2molH2O2转移2mol电子,则0.1mol转移0.1mol电子;
C、胶体为许多分子的聚合体;
D、N2和CO的摩尔质量均为28g/mol.
解答 解:A、由于反应产物中氧元素的化合价没有确定,故标况下11.2LO2参加反应转移的电子数不一定是2NA,故A错误;
B、2H2O2$\frac{\underline{\;加热\;}}{\;}$2H2O+O2↑,2molH2O2转移2mol电子,则0.1mol转移0.1mol电子,转移电子数为0.1×6.02×1023,故B错误;
C、氢氧化铝胶粒是许多氢氧化铝微粒的聚集体,故0.1molAlCl3完全水解转化为氢氧化铝胶体,生成胶粒数小于0.1NA,故C错误;
D、N2和CO的摩尔质量均为28g/mol,故28g混合气体的物质的量为1mol,则含有的分子数为NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
12.一定温度下,反应A2(g)+B2(g)?2AB(g)达到平衡的标志是( )
| A. | 单位时间内生成n molA2同时生成n molAB | |
| B. | 单位时间内生成2n molAB的同时生成n molB2 | |
| C. | 容器内气体总压强不再随时间的变化而变化 | |
| D. | 容器内混合气体的平均摩尔质量不再随时间的变化而变化 |
10.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关,下列说法中不正确的是( )
| A. | 由Al、Cu、稀H2SO4组成原电池,放电时SO42-向Al电极移动 | |
| B. | 由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e+4OH-═AlO2-+2H2O | |
| C. | 由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-═Cu2+ | |
| D. | 由Al、Cu、浓硝酸组成原电池作电源,其负极反应式为:Cu-2e-═Cu2+ |
17.常温下时,有pH=3的盐酸和醋酸溶液,下列说法正确的是( )
| A. | 两种溶液中由水电离出来的c(H+)不相同 | |
| B. | 中和相同体积的两种酸溶液所需NaOH的物质的量相同 | |
| C. | 分别用燕馏水稀释m倍和n倍,若两溶液pH仍相同,则m<n | |
| D. | 将两溶液等体积混合,则c(H+)>c(CH3COO-)═c(Cl-)>c(OH-) |
7.相关化学用语表示正确的是( )
| A. | NH4Br的电子式: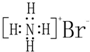 | |
| B. | S原子的结构示意图: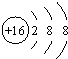 | |
| C. | 次氯酸的电子式: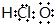 | |
| D. | 原子核内有18个中子的氯原子:${\;}_{17}^{35}$Cl |
14.关于如图所示的原电池,下列说法错误的是( )
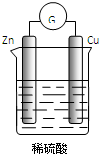

| A. | Cu为正极,Zn为负极 | B. | 该装置能将化学能转化为电能 | ||
| C. | 电子由铜片通过导线流向锌片 | D. | 正极反应为:2H++2e-═H2↑ |
11.我国明代宋应星所著《天工开物》中有关于“升炼倭铅”的记载:“炉甘石(碳酸锌)十斤,装载入一泥罐内,封裹泥固,…,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,…,冷定毁罐取出,…,即倭铅也,…,以其似铅而性猛,故名之曰倭”,下列对于这段话中描述的理解错误的是( )
| A. | 我国历史上铅的使用早于锌 | B. | 锌和铅有相似性但锌更活泼 | ||
| C. | 所得产品中混有煤炭 | D. | 属于热还原法冶炼金属 |
12.下列反应的离子方程式正确的是( )
| A. | 足量的CO2通入饱和碳酸钠溶液中:CO2+CO32-十H2O═2HCO3- | |
| B. | 少量小苏打溶液滴入Ba(OH)2溶液中:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| C. | 硫氢化钠发生水解:HS-+H2O?H3O++S2- | |
| D. | 氧化亚铁加入稀硝酸:FeO+2H+═Fe2++H2O |