题目内容
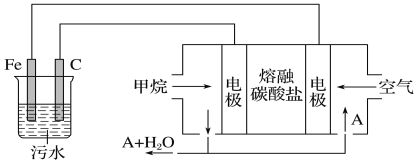
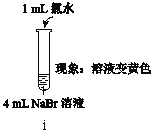
【题目】如图所示的电解装置可实现低电位下高效催化还原CO2。下列说法不正确的是( )
A.a极连接外接电源的负极
B.电解过程中Na+从右池移向左池
C.b极的电极反应式为Cl--2e-+H2O=ClO-+2H+
D.外电路上每转移1 mol电子,理论可催化还原标况下CO2气体11.2 L
【答案】C
【解析】
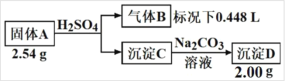
从图示中可以看出,b电极上Cl-失去电子生成ClO-,b电极为电解池阳极;a电极上CO2得到电子生成CO,a电极为电解池阴极;与b极相连的电池一极为正极,与a极相连的电池一极为负极。
A.根据分析,a极与外电路相连的一极为负极,A正确;
B.根据分析,阴极反应为CO2+2e-+H2O=CO+2OH-,生成大量阴离子,为平衡电荷,Na+向左边移动,B正确;
C.因右池电解液中含有大量的OH-,故电极方程式中不能出现H+,正确的电极方程式为Cl--2e-+2OH-=H2O+ClO-,C错误;
D.根据B选项的电极反应,每转移2mol电子,可还原标况下22.4L的CO2,故电路中转移1mol电子,可还原标况下11.2L的CO2,D正确;
故选C。

【题目】.某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(实验原理)2KMnO4+5H2C2O4+3H2SO4=2MnSO4+10CO2↑+K2SO4+8H2O
(实验内容及记录)
实验 编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
0.6mol/L H2C2O4 溶液 | H2O | 0.2mol/LKMnO4溶液 | 3mol/L稀硫酸 | ||
1 | 3.0 | 2.0 | 1.0 | 2.0 | 4.0 |
2 | 2.0 | 3.0 | 1.0 | 2.0 | 5.2 |
3 | 1.0 | 4.0 | 1.0 | 2.0 | 6.4 |
请回答:
(1)根据表中的实验数据,可以得到的结论是____。
(2)利用实验1中数据计算,所在时间内用KMnO4的浓度变化表示的平均反应速率为:v(KMnO4)=____。
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
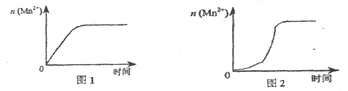
①该小组同学提出的假设是____。
②请你帮助该小组同学完成实验方案,并填写表中空白。
实验 编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
0.6mol/LH2C2O4溶液 | H2O | 0.2mol/LKMnO4溶液 | 3mol/L稀硫酸 | |||
4 | 3.0 | 2.0 | 1.0 | 2.0 | ___ | t |
③若该小组同学提出的假设成立,应观察到的现象是______。
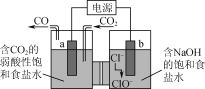
【题目】某小组为探究Cl2、Br2、I2的氧化性强弱,设计实验如下:
资料:稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。
实验Ⅰ |
|
实验Ⅱ | 取ⅰ中的黄色溶液少许,加入KI溶液,再加入淀粉溶液。 |
(1)ⅰ中反应的离子方程式是__。
(2)实验Ⅰ中ⅰ和ⅱ可以得出的结论是__。
(3)①甲同学认为:实验Ⅱ观察到__现象,得出氧化性Br2>I2。
②乙同学对上述实验进行反思,认为实验Ⅱ不能充分证明氧化性Br2>I2,他补做了实验Ⅲ。
实验Ⅲ | 另取ⅰ中的黄色溶液少许,先③步骤步骤,,,,,加入足量的NaBr固体,充分振荡,然后加入KI溶液和淀粉溶液。 |
补做实验Ⅲ的目的是__。
(4)综合实验Ⅰ和Ⅲ,得出氧化性Cl2>Br2>I2。