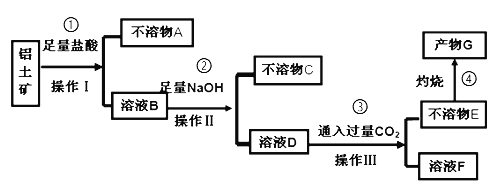
��Ŀ����
����Ŀ��ijС��Ϊ̽��Cl2��Br2��I2��������ǿ�������ʵ�����£�
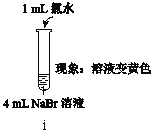
���ϣ�ϡ��ˮ�ʻ�ɫ��Ũ��ˮ�ʺ���ɫ����ˮ���ػ�ɫ��
ʵ��� |
|
ʵ��� | ȡ���еĻ�ɫ��Һ����������KI��Һ���ټ��������Һ�� |
��1�����з�Ӧ�����ӷ���ʽ��__��
��2��ʵ����Т��͢����Եó��Ľ�����__��
��3���ټ�ͬѧ��Ϊ��ʵ���۲쵽__���ó�������Br2��I2��
����ͬѧ������ʵ����з�˼����Ϊʵ����ܳ��֤��������Br2��I2����������ʵ���
ʵ��� | ��ȡ���еĻ�ɫ��Һ�������Ȣ۲��貽�裬������������������NaBr���壬�����Ȼ�����KI��Һ�͵�����Һ�� |
����ʵ����Ŀ����__��
��4���ۺ�ʵ���͢ó�������Cl2��Br2��I2��
���𰸡�Cl2+2Br-=2Cl-+Br2 �����ԣ�Cl2��Br2��Cl2��I2 ��Һ���� �ų����ܴ��ڵ�Cl2��Br2�û���I2�ĸ���
��������
��1�������廯����Һ�м�����ˮ����Һ��Ϊ��ɫ��˵�������嵥�ʣ��γ���ˮ��Һ����ˮ�к����������廯���е�����������Ϊ�嵥�ʣ�
��2��̽��Cl2��Br2��I2��������ǿ����ʵ����Т���ˮ�к����������廯���е�����������Ϊ�嵥�ʣ���Ӧ�����ӷ���ʽ��Cl2+2Br-=2Cl-+Br2��˵��Cl2��������ǿ��Br2������ˮ�к����������⻯���еĵ���������Ϊ�ⵥ�ʣ���Ӧ�����ӷ���ʽ��Cl2+2I-=2Cl-+I2��˵��Cl2��������ǿ��I2��
��3����ȡ���з�Ӧ��Ļ�ɫ��Һ������ˮ��Һ������KI��Һ���ټ��������Һ����������Һ������˵����Ӧ���ɵⵥ�ʣ�˵����ˮ�е�Br2������������Ϊ�ⵥ�ʣ������������������Դ�����������������ԣ�
��ʵ���ȡ���еĻ�ɫ��Һ�������飬���з�Ӧ��Ļ�ɫ��Һ���ܺ��й�������ˮ���������⻯���еĵ���������Ϊ�ⵥ�ʣ�����ȷ֤��һ������ˮ������������Ϊ�ⵥ�ʣ�����Ҫ�Ԣ��з�Ӧ��Ļ�ɫ��Һ�����������廯�ƣ�ȷ����Һ���з�Ӧ�����Һ��������ˮ��
��1�������廯����Һ�м�����ˮ����Һ��Ϊ��ɫ��˵�������嵥�ʣ��γ���ˮ��Һ����ˮ�к����������廯���е�����������Ϊ�嵥�ʣ���Ӧ�����ӷ���ʽ��Cl2+2Br-=2Cl-+Br2��
�ʴ�Ϊ��Cl2+2Br-=2Cl-+Br2��
��2��̽��Cl2��Br2��I2��������ǿ����ʵ����Т���ˮ�к����������廯���е�����������Ϊ�嵥�ʣ���Ӧ�����ӷ���ʽ��Cl2+2Br-=2Cl-+Br2��˵��Cl2��������ǿ��Br2������ˮ�к����������⻯���еĵ���������Ϊ�ⵥ�ʣ���Ӧ�����ӷ���ʽ��Cl2+2I-=2Cl-+I2��˵��Cl2��������ǿ��I2��
�ʴ�Ϊ�������ԣ�Cl2��Br2��Cl2��I2��
��3����ȡ���еĻ�ɫ��Һ����ˮ��Һ������KI��Һ���ټ��������Һ����������Һ������˵����Ӧ���ɵⵥ�ʣ�������ӦΪBr2+2I-=2Br-+I2��˵����ˮ�е�Br2������������Ϊ�ⵥ�ʣ������������������Դ�����������������ԣ��ó�������Br2��I2��
�ʴ�Ϊ����Һ������
��ʵ����ȡ���еķ�Ӧ��Ļ�ɫ��Һ�������飬���еĻ�ɫ��Һ���ܺ��й�������ˮ���������⻯���еĵ���������Ϊ�ⵥ�ʣ�����ȷ֤��һ������ˮ������������Ϊ�ⵥ�ʣ�����Ҫ�����еĻ�ɫ��Һ�����������廯�ƣ�ȷ����Ӧ�����Һ���з�Ӧ�����Һ��������ˮ����˲���ʵ����Ŀ�����ų����ܴ��ڵ�Cl2��Br2�û���I2�ĸ��ţ�
�ʴ�Ϊ���ų����ܴ��ڵ�Cl2��Br2�û���I2�ĸ��š�