题目内容
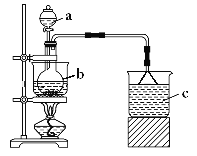
【题目】实验室中所用少量氯气是用MnO2和浓盐酸制取的,用浓盐酸200ml,其密度为1.19g·cm-3,HCl的质量分数为36.5%,跟MnO2恰好完全反应,产生了11.2L(标况)的氯气。试计算:
①浓盐酸的物质的量浓度?___
②求参加反应的HCl的物质的量?___
③被氧化的HCl的质量?___
【答案】11.9mol/L 2mol 36.5g
【解析】
根据c=![]() 及MnO2+4HCl(浓)
及MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O进行计算。
MnCl2+Cl2↑+2H2O进行计算。
①c=![]() =11.9mol/L;
=11.9mol/L;
②根据MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,参加反应的n(HCl):n(Cl2)=4:1,生成11.2L(标况)的氯气,n(Cl2)=0.5mol,参加反应的n(HCl)=2mol;
MnCl2+Cl2↑+2H2O,参加反应的n(HCl):n(Cl2)=4:1,生成11.2L(标况)的氯气,n(Cl2)=0.5mol,参加反应的n(HCl)=2mol;
③根据反应可知,被氧化的氯化氢占反应消耗氯化氢的一半,所以被氧化的氯化氢为1mol,氯气的质量为m=n×M=1×36.5=36.5g。

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
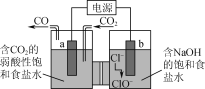
蓝天教育暑假优化学习系列答案【题目】化学需氧量(chemical oxygen demand,简称COD)表示在强酸性条件下重铬酸钾氧化 1 L 污水中有机物所需的氧化剂的量,并换算成以氧气为氧化剂时,1 L水样所消耗O2的质量(mg·L-1)计算。COD小,水质好。某湖面出现赤潮,某化学兴趣小组为测定其污染程度,用 1.176 g K2Cr2O7固体配制成 100 mL溶液,现取水样20.00 mL,加入10.00 mL K2Cr2O7溶液,并加入适量酸和催化剂,加热反应2 h。多余的K2Cr2O7用0.100 0 mol·L-1Fe(NH4)2(SO4)2溶液进行滴定,消耗Fe(NH4)2(SO4)2溶液的体积如下表所示。此时,发生的反应是CrO72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。(已知K2Cr2O7和有机物反应时被还原为 Cr3+,K2Cr2O7的相对分子质量为294)
序号 | 起始读数/mL | 终点读数/mL |
1 | 0.00 | 12.10 |
2 | 1.26 | 13.16 |
3 | 1.54 | 14.64 |
(1)K2Cr2O7溶液的物质的量浓度为______mol·L-1。
(2)求该湖水的COD为______mg·L-1。
【题目】某小组探究Na2SO3溶液和KIO3溶液的反应。
实验I:向某浓度的KIO3酸性溶液(过量)中加入Na2SO3溶液(含淀粉),一段时间(t秒)后,溶液突然变蓝。
资料:IO3-在酸性溶液氧化I-,反应为IO3- + 5I- + 6H+ = 3I2 + 3H2O
(1)溶液变蓝,说明Na2SO3具有_________性。
(2)针对t秒前溶液未变蓝,小组做出如下假设:
i.t秒前未生成I2,是由于反应的活化能______(填“大”或“小”),反应速率慢导致的。
ii.t秒前生成了I2,但由于存在Na2SO3,_____(用离子方程式表示),I2被消耗。
(3)下述实验证实了假设ii合理。
实验II:向实验I的蓝色溶液中加入_______,蓝色迅速消失,后再次变蓝。
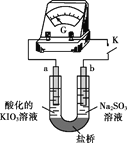
(4)进一步研究Na2SO3溶液和KIO3溶液反应的过程,装置如下。
实验III:K闭合后,电流表的指针偏转情况记录如下表:
表盘 | |
| ||
时间/min | 0~t1 | t2~t3 | t4 | |
偏转 位置 | 右偏至Y | 指针回到“0”处,又返至“X”处;如此周期性往复多次…… | 指针 归零 | |
① K闭合后,取b极区溶液加入盐酸酸化的BaCl2溶液,现象是______。
② 0~t1时,从a极区取溶液于试管中,滴加淀粉溶液,溶液变蓝;直接向a极区滴加淀粉溶液,溶液未变蓝。判断IO3- 在a极放电的产物是_______。
③ 结合反应解释t2~t3时指针回到“0”处的原因:________。
(5)综合实验I、II、III,下列说法正确的是_______。
A.对比实验I、II,t秒后溶液变蓝,I中SO32-被完全氧化
B.对比实验I、III,t秒前IO3- 未发生反应
C.实验III中指针返回X处的原因,可能是I2氧化SO32-