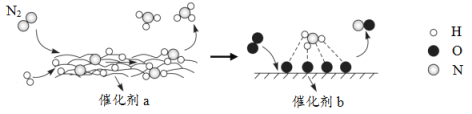
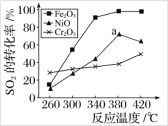
题目内容
【题目】电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0,
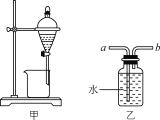
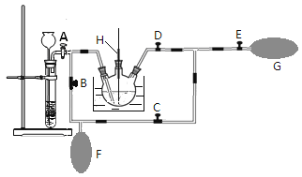
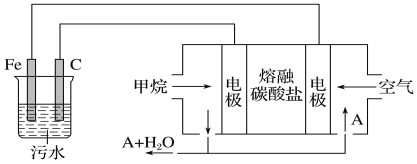
通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,弃去浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计的装置示意图如下图所示。
(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的________。
a.H2SO4 b.CH3CH2OH c.Na2SO4 d.NaOH
(2)电解过程中,电解池阳极发生了两个电极反应,其中一个为2H2O-4e-=O2↑+4H+,则另一个电极反应式为_____________________________。
(3)电解池溶液中得到Fe(OH)3沉淀的离子方程式为_____________________________。
(4)熔融盐燃料电池以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料为电极。
①正极的电极反应式为______________________________________;
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此电池工作时必须有部分A物质参加循环。则A物质的化学式是___________。
(5)实验过程中,若在阴极产生了44.8 L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况)________L。
【答案】c Fe-2e-===Fe2+ 4Fe2++10H2O+O2===4Fe(OH)3↓+8H+或4Fe2++4H++O2===4Fe3++2H2O,Fe3++3OH-===Fe(OH)3↓ O2+2CO2+4e-===2CO32-(或2O2+4CO2+8e-===4CO32-) CO2 11.2
【解析】
A装置为电解池,B装置为原电池装置,原电池工作时,通入甲烷的一级为负极,发生氧化反应,负极电极反应是CH4+4CO32--8e-=5CO2+2H2O,通入氧气的一极为正极,发生还原反应,正极反应为O2+2CO2+4e-=2CO32-,电解池中Fe为阳极,发生Fe-2e-=Fe2+,阴极的电极反应为:2H++2e-=H2↑,二价铁离子具有还原性,能被氧气氧化到正三价,4Fe2++10H2O+O2=4Fe(OH)3↓+8H+。
(1)由题意可知,保持保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀时,加入能使溶液导电能力增强的电解质,必须是可溶于水的、显中性的盐,故选c,故答案为:c;
(2)燃料电池中通入空气的电极是正极,通入甲烷的电极是负极,铁与正极相连作阳极,活泼金属电极做电解池的阳极时,电极本身失去电子,电极反应式为Fe-2e-=Fe2+,故答案为:Fe-2e-=Fe2+;
(3)阳极铁失去电子转化为亚铁离子,亚铁离子具有还原性,能被氧气氧化生成铁离子,铁离子与氢氧根离子结合生成氢氧化铁红褐色沉淀,反应的离子方程式可表示为4Fe2++10H2O+O2=4Fe(OH)3↓+8H+,故答案为:4Fe2++10H2O+O2=4Fe(OH)3↓+8H+;
(4)①燃料电池中,正极得到电子发生还原反应,即一定是氧气得电子的过程。由于电解质是熔融碳酸盐,因此正极电极反应为O2+2CO2+4e-=2CO32-,故答案为:O2+2CO2+4e-=2CO32-;
②负极甲烷失去电子转化为CO2,而正极需要消耗CO2,所以可以循环利用的物质是CO2,故答案为:CO2;
(5)阴极电极反应为2H++2e-=H2↑,即44.8L(标准状况)气体是氢气,物质的量是2mol,转移电子的物质的量为4mol。根据电池的负极电极反应CH4+4CO32--8e-=5CO2+2H2O可知当转移4mol电子时,消耗CH40.5mol,在标准状况下的体积V=0.5mol×22.4L/mol=11.2L,故答案为:11.2。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案【题目】化学需氧量(chemical oxygen demand,简称COD)表示在强酸性条件下重铬酸钾氧化 1 L 污水中有机物所需的氧化剂的量,并换算成以氧气为氧化剂时,1 L水样所消耗O2的质量(mg·L-1)计算。COD小,水质好。某湖面出现赤潮,某化学兴趣小组为测定其污染程度,用 1.176 g K2Cr2O7固体配制成 100 mL溶液,现取水样20.00 mL,加入10.00 mL K2Cr2O7溶液,并加入适量酸和催化剂,加热反应2 h。多余的K2Cr2O7用0.100 0 mol·L-1Fe(NH4)2(SO4)2溶液进行滴定,消耗Fe(NH4)2(SO4)2溶液的体积如下表所示。此时,发生的反应是CrO72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。(已知K2Cr2O7和有机物反应时被还原为 Cr3+,K2Cr2O7的相对分子质量为294)
序号 | 起始读数/mL | 终点读数/mL |
1 | 0.00 | 12.10 |
2 | 1.26 | 13.16 |
3 | 1.54 | 14.64 |
(1)K2Cr2O7溶液的物质的量浓度为______mol·L-1。
(2)求该湖水的COD为______mg·L-1。
【题目】某小组探究Na2SO3溶液和KIO3溶液的反应。
实验I:向某浓度的KIO3酸性溶液(过量)中加入Na2SO3溶液(含淀粉),一段时间(t秒)后,溶液突然变蓝。
资料:IO3-在酸性溶液氧化I-,反应为IO3- + 5I- + 6H+ = 3I2 + 3H2O
(1)溶液变蓝,说明Na2SO3具有_________性。
(2)针对t秒前溶液未变蓝,小组做出如下假设:
i.t秒前未生成I2,是由于反应的活化能______(填“大”或“小”),反应速率慢导致的。
ii.t秒前生成了I2,但由于存在Na2SO3,_____(用离子方程式表示),I2被消耗。
(3)下述实验证实了假设ii合理。
实验II:向实验I的蓝色溶液中加入_______,蓝色迅速消失,后再次变蓝。
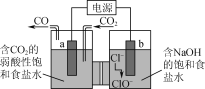
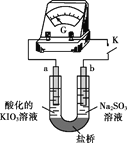
(4)进一步研究Na2SO3溶液和KIO3溶液反应的过程,装置如下。
实验III:K闭合后,电流表的指针偏转情况记录如下表:
表盘 | |
| ||
时间/min | 0~t1 | t2~t3 | t4 | |
偏转 位置 | 右偏至Y | 指针回到“0”处,又返至“X”处;如此周期性往复多次…… | 指针 归零 | |
① K闭合后,取b极区溶液加入盐酸酸化的BaCl2溶液,现象是______。
② 0~t1时,从a极区取溶液于试管中,滴加淀粉溶液,溶液变蓝;直接向a极区滴加淀粉溶液,溶液未变蓝。判断IO3- 在a极放电的产物是_______。
③ 结合反应解释t2~t3时指针回到“0”处的原因:________。
(5)综合实验I、II、III,下列说法正确的是_______。
A.对比实验I、II,t秒后溶液变蓝,I中SO32-被完全氧化
B.对比实验I、III,t秒前IO3- 未发生反应
C.实验III中指针返回X处的原因,可能是I2氧化SO32-