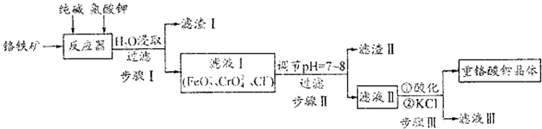
题目内容
11.氢化钙(CaH2)固体是一种储氢材料,是登山运动员常用的能源提供剂.钙在加热时能与氮气、氢气反应.氢化钙遇水立即反应生成氢氧化钙和氢气.氢化钙通常用氢气与金属钙加热制取,如图是模拟制取装置.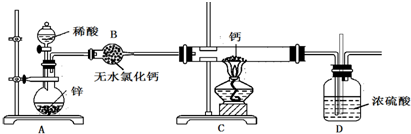
(1)下列关于氢化钙的叙述正确的是c(选填序号).
a.氢化钙中阴离子的半径小于Li+的半径
b.氢化钙的式量小于溴化氢,因此前者的熔点小于后者
c.氢化钙也能与盐酸反应生成氢气
d.氢气常用作还原剂,只具有还原性
(2)图A装置中制备氢气所用的酸溶液最好选用b(选填序号).
a.稀盐酸 b.稀硫酸 c.稀硝酸 d.均可以
(3)装置D中竖直导管的作用是平衡压强,防止液体倒流.
(4)为了确认进入装置C的氢气已经干燥,可在B、C之间再接一装置,该装置中加入的试剂是无水硫酸铜.加热C装置前要对H2验纯,验纯的操作是收集一试管气体,将管口靠近酒精灯火焰,若听到“噗噗”的声音.
(5)甲同学认为只要装置合理、操作规范就可以排除生成a.b.c(选填序号).
a.Ca3N2 b.CaO c.Ca(OH)2
(6)乙同学用如图装置测定制得的氢化钙的纯度.他称取48g样品,与足量的水反应,恒温时,注射器量出产生的气体为48.16L(已换算为标准状况).假设钙只与氢气发生了反应,请根据乙同学的实验数据计算氢化钙的纯度(写出计算过程)87.5%.

分析 氢化钙的制备:锌和稀硫酸反应:Zn+H2SO4=ZnSO4+H2↑,氢气中含有水蒸气,通过无水氯化钙进行干燥,在装置C中和钙进行反应Ca+H2$\frac{\underline{\;\;△\;\;}}{\;}$CaH2,生成氢化钙,因氢化钙遇水立即反应生成氢氧化钙和氢气,所以D防止空气中的水蒸气进行C中.
(1)a.核外电子排布相同,核电荷数越大离子半径越小;
b.一般离子晶体熔点大于分子晶体;
c.氢化钙与盐酸反应生成氯化钙和氢气;
d.氢气常用作还原剂,也具有氧化性;
(2)a.稀盐酸具有挥发性,制得的气体中含有氯化氢;
b.稀硫酸与金属制取氢气,不含酸性杂质气体;
c.稀硝酸具有挥发性,且与金属反应无氢气;
d.根据分析只有硫酸可以;
(3)装置D空气中的水蒸气进行C中,且排出尾气,竖直导管能平衡压强,防止液体倒流;
(4)确认进入装置C的氢气已经干燥,可在B、C之间再接一装置干燥管,利用干燥管中的无水硫酸铜遇到水是否变蓝色,证明氢气是否已经干燥;依据氢气的验纯方法分析判断;
(5)钙在加热时能与氮气、氢气反应,氢化钙遇水立即反应生成氢氧化钙和氢气,上述装置制备过程中先利用生成的氢气充满整套装置,在最后收集验纯,所以装置中无空气存在,不会生成氮化钙,无水蒸气存在,不会生成氢氧化钙和氧化钙;
(6)设混合物中氢化钙的质量为x,根据方程式CaH2+2H2O═Ca(OH)2+2H2↑、Ca+2H2O═Ca(OH)2+H2↑,列方程计算x的值,再根据质量分数定义计算.
解答 解:(1)a.H-与Li+核外电子排布相同,核电荷数越大离子半径越小,故离子半径H->Li+,故a错误;
b.氢化钙为离子晶体,溴化氢为分子晶体,前者的熔点大于后者,不同类型的晶体熔点比较与式量无关,故b错误;
c.氢化钙与盐酸反应:CaH2+2HCl=CaCl2+H2↑,能生成氢气,故c正确;
d.氢气常用作还原剂,但Ca+H2$\frac{\underline{\;\;△\;\;}}{\;}$CaH2,氢气具有氧化性,故d错误;
故答案为:c;
(2)a.稀盐酸具有挥发性,制得的氢气中含有氯化氢,故a不选;
b.稀硫酸难挥发,与锌反应生成的氢气中除含水蒸气,无其它杂质,故b选;
c.稀硝酸与锌无氢气产生,故c不选;
d.通过以上分析,只有稀硫酸可以,故d不选;
故答案为:b;
(3)因氢化钙遇水立即反应生成氢氧化钙和氢气,所以D防止空气中的水蒸气进行C中,且排出尾气,竖直导管能平衡压强,防止液体倒流,
故答案为:平衡压强,防止液体倒流;
(4)确认进入装置C的氢气已经干燥,可在B、C之间再接一装置干燥管,利用干燥管中的无水硫酸铜遇到水是否变蓝色,证明氢气是否已经干燥;依据氢气的验纯方法是收集一试管气体,将管口靠近酒精灯火焰,若听到“噗噗”的声音,说明H2已经纯净;
故答案为:无水硫酸铜;收集一试管气体,将管口靠近酒精灯火焰,若听到“噗噗”的声音;
(5)钙在加热时能与氮气、氢气反应.氢化钙遇水立即反应生成氢氧化钙和氢气,上述装置制备过程中先利用生成的氢气充满整套装置,在最后收集验纯,所以装置中无空气存在,不会生成氮化钙(a),无水蒸气存在,不会生成氢氧化钙和氧化钙(b.c),
故答案为:a.b.c;
(6)设混合物中氢化钙的质量为x,则钙的质量为48g-x,则:
CaH2+2H2O═Ca(OH)2+2H2↑
42 2
x $\frac{2x}{42}$
Ca+2H2O═Ca(OH)2+H2↑
40 1
48g-x $\frac{48g-x}{40}$
$\frac{2x}{42}+\frac{48-x}{40}$=$\frac{48.16L}{22.4L/mol}$解得:x=42,则氢化钙的纯度:$\frac{42g}{48g}×100%$=87.5%,
故答案为:87.5%.
点评 本题以氢化钙制备为载体,考查实验基本技能与操作、对题中的信息的利用、对实验装置的理解分析、物质分离提纯、化学计算、实验方案设计等,是对学生综合能力的考查,题目难度中等.

 阅读快车系列答案
阅读快车系列答案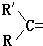 变成
变成 .现有某烯烃A,分子式为C4H8,被酸性高锰酸钾溶液氧化后不可能得到的产物是( )
.现有某烯烃A,分子式为C4H8,被酸性高锰酸钾溶液氧化后不可能得到的产物是( )| A. | CH3COOH | B. | CO2和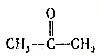 | ||
| C. | CO2和CH3CH2COOH | D. | HCOOH和CH3CH2COOH |
| A. | F- | B. | Mg2+ | C. | Cl- | D. | Na+ |

 ,写出更改试剂(气体过量)后生成沉淀E所发生反应的离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
,写出更改试剂(气体过量)后生成沉淀E所发生反应的离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.