题目内容
20.电解质的水溶液中存在电离平衡,醋酸是常见的弱酸.(1)①醋酸在水溶液中的电离方程式为CH3COOH?H++CH3COO-
②下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是bc(填字母序号).
a.滴加少量浓盐酸 b.微热溶液
c.加水稀释 d.加入少量醋酸钠晶体
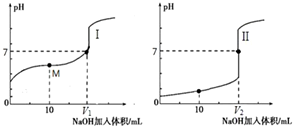
(2)用0.1mol•L-1NaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol•L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线.
①滴定醋酸的曲线是Ⅰ(填“I”或“II”).
②V1和V2的关系:V1>V2(填“>”、“=”或“<”).
③M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
分析 (1)①醋酸是弱电解质,在水溶液里部分电离出醋酸根离子与氢离子;
②醋酸的电离是吸热反应,加水稀释、加入碱、加热都能促进醋酸的电离;
(2)①根据浓度均为0.1mol•L-1的盐酸和醋酸溶液的pH不一样来回答;
②醋酸钠显示碱性,氯化钠显示中性;
③0.1mol•L-1 NaOH溶液10mL和溶液体积为20.00mL0.1mol•L-1的醋酸反应,得到的是醋酸和醋酸钠的混合物,据此确定离子浓度大小.
解答 解:(1)①醋酸是弱电解质,在水溶液里部分电离,电离方程式为:CH3COOH?H++CH3COO-,故答案为:CH3COOH?H++CH3COO-;
②醋酸的电离是吸热反应,加水稀释、加入碱、加热都能促进醋酸的电离;
a.加入浓盐酸,溶液中氢离子浓度增大,抑制醋酸的电离,则醋酸的电离程度降低,故错误;
b.醋酸的电离是吸热反应,加热CH3COOH溶液,促进醋酸的电离,则醋酸的电离程度增大,故正确;
c.加水稀释,促进醋酸的电离,则醋酸的电离程度增大,故正确;
d.加入少量醋酸钠,醋酸的电离平衡向逆反应方向移动,醋酸的电离程度降低,故错误;
故答案为:bc;
(2)①浓度均为0.1mol•L-1的盐酸和醋酸溶液的pH,盐酸的等于1,但是醋酸的大于1,所以滴定醋酸的曲线是I,
故答案为:I;
②醋酸和氢氧化钠之间的反应,当恰好完全反应得到的醋酸钠显示碱性,要使得溶液显示中性,pH=7,需要醋酸稍过量,所以盐酸和氢氧化钠恰好完全反应,得到的氯化钠显示中性,所以V1>V2,
故答案为:>;
③用0.1mol•L-1 NaOH溶液10mL和溶液体积为20.00mL0.1mol•L-1的醋酸反应,得到的是醋酸和醋酸钠的混合物,显示酸性,此时离子浓度大小c(CH3COO-)>c (Na+)>c (H+)>c (OH-),
故答案为:c(CH3COO-)>c (Na+)>c (H+)>c (OH-).
点评 本题综合考查学生酸碱滴定以及溶液中离子浓度大小比较的知识,属于综合知识的考查,题目难度中等,图象分析判断是解题关键,掌握基础是关键.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
| A. | 该分子中所有氢原子不可能在同一平面上 | |
| B. | 1mol该物质与氢气反应,最多消耗4mol氢气 | |
| C. | 加入FeCl3溶液呈紫色,因为该物质含有酚类结构特征 | |
| D. | 滴入酸性高锰酸钾溶液,紫色褪去,可证明结构存在碳碳双键 |
| A. | 苯酚呈弱酸性,能使石蕊试液显浅红色 | |
| B. | 苯酚分子中的13个原子有可能处于同一平面上 | |
| C. | 苯酚有强腐蚀性,沾在皮肤上可以用NaOH溶液洗涤 | |
| D. | 苯酚能与FeCl3溶液反应生成紫色沉淀 |

 乙醇的沸点是78℃,能与水以任意比混溶,易与氯化钙结合生成配合物.乙醚的沸点为34.6℃,难溶于水,乙醚极易燃烧.实验室制乙醚的反应原理是:
乙醇的沸点是78℃,能与水以任意比混溶,易与氯化钙结合生成配合物.乙醚的沸点为34.6℃,难溶于水,乙醚极易燃烧.实验室制乙醚的反应原理是: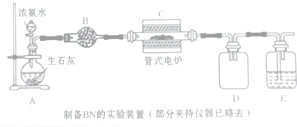
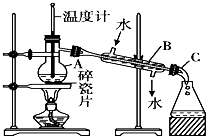 请回答实验室分馏石油的有关问题:
请回答实验室分馏石油的有关问题: