题目内容
10.烯烃被酸性高锰酸钾溶液氧化的规律是烯烃中双键断裂,双键两端的基团:=CH2变成CO2;=CHR变成RCOOH;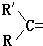 变成
变成 .现有某烯烃A,分子式为C4H8,被酸性高锰酸钾溶液氧化后不可能得到的产物是( )
.现有某烯烃A,分子式为C4H8,被酸性高锰酸钾溶液氧化后不可能得到的产物是( )| A. | CH3COOH | B. | CO2和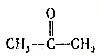 | ||
| C. | CO2和CH3CH2COOH | D. | HCOOH和CH3CH2COOH |
分析 烯烃C4H8,由C4H8的烯烃同分异构体有CH2═CHCH2CH3、CH3-CH═CH-CH3、CH2═C(CH3)2,结合烯烃被酸性KMnO4溶液氧化的规律进行判断.
解答 解:A为烯烃C4H8,C4H8有如下三种同分异构体(不考虑顺反异构):CH2═CHCH2CH3、CH3-CH═CH-CH3、CH2═C(CH3)2,根据题中信息,C4H8双键被氧化断裂的情况如下: 、
、 、
、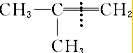 ,
,
三种烯烃被氧化得到的产物有:CO2、CH3CH2COOH、CH3COOH、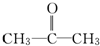 ,则不可能有HCOOH,
,则不可能有HCOOH,
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握烯烃氧化的规律为解答的关键,侧重分析与迁移应用能力的考查,题目难度不大.

练习册系列答案
相关题目
20.1.8g某金属与足量盐酸充分反应,产生2.24LH2(标况下),则该金属是( )
| A. | Zn | B. | Mg | C. | Al | D. | Fe |
1.标准状况下,将42.3L HCl完全溶解于蒸馏水中,得到1.0L溶液,下列叙述正确的是( )
| A. | 得到的盐酸的物质的量浓度为$\frac{\frac{42.3L}{22.4L/mol}}{1.0L}$≈1.9mol•L-1 | |
| B. | 得到的盐酸的密度为$\frac{\frac{42.3L}{22.4L/mol}×36.5g/mol+1000g}{1000mL}$≈1.069g•cm-3 | |
| C. | 得到的盐酸的质量分数为$\frac{\frac{42.3L}{22.4L/mol}×36.5g/mol}{\frac{42.3L}{22.4L/mol}×36.5g/mol+1000g}$×100%≈6.4% | |
| D. | 缺少数据,不能计算所得盐酸的物质的量浓度、密度及质量分数 |
15.在200℃将一定量的O2、CO2和H2O的混合气体经过一定量的碱石灰后,固体质量增加了5.4g,则得到的混合气体(200℃)的平均摩尔质量可能是( )
| A. | 11.5g/mol | B. | 24.3g/mol | C. | 48.4g/mol | D. | 16.2g/mol |
2.填写下表
| 物质 | 摩尔质量 | 物质的量 | 质量 | 分子或离子数目 |
| SO2 | 2mol | |||
| SO42- | 6.02×1022 | |||
| NH4+ | 18g | . |