题目内容
【题目】锗是重要的稀缺战略资源,广泛应用于众多国防军工及民用领域,属于我国战略收储金属。某科研课题采用的提取锗技术路线为:低品位锗精矿-(次亚磷酸钠热还原-真空挥发富集)-挥发产物高品位还原锗精矿-碱氧化预处理-盐酸蒸馏提纯-高纯四氯化锗-高纯二氧化锗。

(1)在周期表中金属与非金属的分界处,可以找到半导体材料,如Si、 等,半导体器件的研制正是开始于 ,后来发展到研制与它同族的 。三种元素依次是_______(填标号)。
a.Ge Si Ge
b.Ge Ge Si
c.C Si Ge
(2)请配平次亚磷酸钠热还原反应的化学方程式并在括号内注明反应条件:
___NaH2PO2·H2O+GeO2 ![]() ___Na4P2O7+___H2O+___GeO↑+___H3PO4,_____________
___Na4P2O7+___H2O+___GeO↑+___H3PO4,_____________
(3)高品位还原锗精矿碱氧化预处理过程的产物是锗酸钠,请写出该过程的化学反应方程式:____________________________________________
(4)高纯二氧化锗含量采用碘酸钾滴定法进行分析。称取3.600g高纯二氧化锗样品,采用氢氧化钠在电炉上溶样,次亚磷酸钠加热还原,然后以淀粉为指示剂,用碘酸钾标准溶液(0.6000mol/L)滴定,消耗的碘酸钾体积为19.00mL。[20℃以下,次亚磷酸钠不会被碘酸钾和碘氧化]
①滴定终点的现象是_____________________________。
②此样品中二氧化锗含量是_________。(保留四位有效数字)
(5)用氢气还原GeO2可制得金属锗。其反应如下:
GeO2+ H2= GeO+ H2O ①
GeO+ H2= Ge+ H2O ②
GeO2+ 2H2= Ge+ 2H2O ③
反应式③ΔH=+13750 kJ/mol ,ΔS=+15600J/(K·mol),则还原反应的温度一般控制在_________℃范围内。[已知GeO在700℃会升华,T(K)=t(℃)+273]
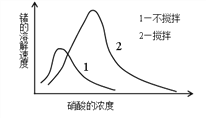
(6)锗在硝酸中的溶解速度受硝酸浓度、搅拌速度、温度等因素影响。如图,锗溶解速度有一最大值,硝酸的浓度小于此值时,随浓度增加溶解速度增加,反之降低,这是由于硝酸浓度高时_________加剧所致。
【答案】 b 4 8 1 5 8 2 反应条件:氮气 900~1000℃ GeO + H2O2 + 2NaOH = Na2GeO3 + 2H2O 溶液变为蓝色,且30s内不褪色 99.75% 608~700 钝化
【解析】试题分析:本题以提取锗的流程为载体,考查流程的分析,氧化还原反应方程式的配平,指定情境下方程式的书写,氧化还原反应的滴定,化学反应自发性的判断,元素周期表的应用。
(1)在周期表中金属与非金属的分界处,可找到半导体材料,如Si、Ge等,半导体器件的研制正是开始于Ge,后来发展到研制与它同族的Si,答案选b。
(2)反应中P元素的化合价由+1价升至+5价,化合价升高4,Ge元素的化合价由+4价降至+2价,化合价降低2,根据得失电子守恒和原子守恒可配平为:4NaH2PO2·H2O+8GeO2=Na4P2O7+5H2O+8GeO↑+2H3PO4。根据流程,反应条件为:氮气、900~1000℃。
(3)高品位还原锗精矿主要成分为GeO,碱氧化预处理加入NaOH、H2O2、H2O,两者作用生成Na2GeO3,GeO被氧化成Na2GeO3,则H2O2被还原成H2O,反应的化学方程式为:GeO+2NaOH+H2O2=Na2GeO3+2H2O。
(4)①根据滴定过程,次亚磷酸钠将GeO2还原为GeO,KIO3将GeO氧化,自身被还原成I-,GeO被完全消耗,再滴入KIO3溶液,KIO3与I-发生归中反应生成I2,I2遇淀粉呈蓝色,滴定终点的现象:溶液变为蓝色,且30s内不褪色。
②根据得失电子守恒,2n(GeO2)=6n(KIO3),n(GeO2)=3n(KIO3)=3![]() 0.6mol/L
0.6mol/L![]() 0.019L=0.0342mol,m(GeO2)=0.0342mol
0.019L=0.0342mol,m(GeO2)=0.0342mol![]() 105g/mol=3.591g,样品中GeO2含量为
105g/mol=3.591g,样品中GeO2含量为![]() 100%=99.75%。
100%=99.75%。
(5)使还原反应进行,反应③ΔG=ΔH-TΔS=+13750kJ/mol-15.6kJ/(K·mol)T![]() 0,T
0,T![]() 881K,即温度高于881-273=608℃,由于GeO在700℃会升华,所以还原反应的温度一般控制在608℃~700℃范围内。
881K,即温度高于881-273=608℃,由于GeO在700℃会升华,所以还原反应的温度一般控制在608℃~700℃范围内。
(6)Ge与Al在周期表中处于对角线,Ge的性质与Al相似,HNO3浓度高时,Ge的溶解速率随浓度增加而降低,这是由于HNO3浓度高时钝化加剧所致。

 名校课堂系列答案
名校课堂系列答案【题目】(1)如下图所示,左室容积为右室的两倍,温度相同,现分别按照如图所示的量充入气体,同时加入少量固体催化剂使两室内气体充分反应达到平衡,打开活塞,继续反应再次达到平衡,下列说法正确的是_____

A.第一次平衡时,SO2的物质的量右室更多
B.通入气体未反应前,左室压强和右室一样大
C.第一次平衡时,左室内压强一定小于右室
D.第二次平衡时,SO2的总物质的量比第一次平衡时左室SO2的物质的量的2倍还要多
(2)NH3合成常见的化肥尿素【化学式为CO(NH2)2】分为三步,其中第一步为:2NH3(g)+CO2(g)![]() NH2COONH4(s) ΔH= -159.5kJ/mol,对于这个反应,在2L等容密闭容器中充入2molNH3和1molCO2,平衡时放出127.6kJ的热量,若反应温度不变,在该容器中充入2.8molNH3和1.4molCO2,到达平衡时,c(NH3)为___________。
NH2COONH4(s) ΔH= -159.5kJ/mol,对于这个反应,在2L等容密闭容器中充入2molNH3和1molCO2,平衡时放出127.6kJ的热量,若反应温度不变,在该容器中充入2.8molNH3和1.4molCO2,到达平衡时,c(NH3)为___________。
(3)①室温下,在0.5mol/L纯碱溶液中加入少量水,由水电离出的c(H+)×c(OH-)_________。(填“变大”、“变小”、“不变”)
②已知Ksp(Ag2CrO4)=1.0×10-12,向0.2mol/L的AgNO3溶液中加入等体积的0.00008mol/LK2CrO4溶液,则溶液中的c(CrO42-)=___________。
③室温下,0.1mol/LNaHCO3溶液的pH值______0.1mol/LNa2SO3溶液的pH值(填“>”、“<”、“=”)已知:
H2CO3 | K1=4.3×10-7 | K2=5.6×10-11 |
H2SO3 | K1=1.54×10-2 | K2=1.02×10-7 |
(4)有一种可充电电池Na—Al/FeS,电池工作时Na+的物质的量保持不变,并且是用含Na+的导电固体作为电解质,已知该电池正极反应式为2Na++FeS+2e—=Na2S+Fe,则该电池在充电时,阳极发生反应的物质是____________,放电时负极反应式为__________________。
【题目】根据下列五种短周期元素的电离能数据(单位:kJ/mol),回答下面各题。
元素代号 | I1 | I2 | I3 | I4 | I5 |
Q | 800.6 | 2427.1 | 3659.7 | 25025.8 | 32826.7 |
R | 495.8 | 4562 | 6910.3 | 9543 | 13354 |
S | 577.5 | 1816.7 | 2744.8 | 11577 | 14842 |
T | 1402.3 | 2856 | 4578.1 | 7475.0 | 9444.9 |
U | 2080.7 | 3952.3 | 6122 | 9371 | 12177 |
(1)在这五种元素中,最可能处于同一族的两种元素是_________(填元素符号),S元素最可能是_____区元素
(2)基态Q元素原子的价电子排布式是____________。Q和T同周期。化合物QT中T元素的化合价为_______;第一电离能介于Q、T之间的同周期元素有______种。
(3)化合物RT3中化学键类型为_______,RT3的阴离子的几何构型为________。
(4)下列元素中,化学性质和物理性质最像U元素的是_____________
A.硼 B.铍 C.锂 D.氦 E.碳
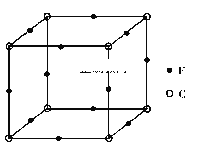
(5)R的某种氧化物X晶胞结构如图所示,晶胞参数a=0.566 nm,X的化学式为_____;列式并计算晶体X的密度(g·cm-3)_____。