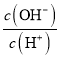��Ŀ����
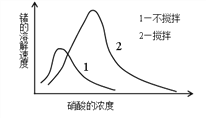
����Ŀ����1������ͼ��ʾ�������ݻ�Ϊ���ҵ��������¶���ͬ���ֱַ�����ͼ��ʾ�����������壬ͬʱ���������������ʹ�����������ַ�Ӧ�ﵽƽ�⣬������������Ӧ�ٴδﵽƽ�⣬����˵����ȷ����_____

A����һ��ƽ��ʱ��SO2�����ʵ������Ҹ���
B��ͨ������δ��Ӧǰ������ѹǿ������һ����
C����һ��ƽ��ʱ��������ѹǿһ��С������
D���ڶ���ƽ��ʱ��SO2�������ʵ����ȵ�һ��ƽ��ʱ����SO2�����ʵ�����2����Ҫ��
��2��NH3�ϳɳ����Ļ������ء���ѧʽΪCO(NH2)2����Ϊ���������е�һ��Ϊ��2NH3(g)+CO2(g)![]() NH2COONH4(s) ��H= -159.5kJ/mol�����������Ӧ����2L�����ܱ������г���2molNH3��1molCO2��ƽ��ʱ�ų�127.6kJ������������Ӧ�¶Ȳ��䣬�ڸ������г���2.8molNH3��1.4molCO2������ƽ��ʱ��c��NH3��Ϊ___________��
NH2COONH4(s) ��H= -159.5kJ/mol�����������Ӧ����2L�����ܱ������г���2molNH3��1molCO2��ƽ��ʱ�ų�127.6kJ������������Ӧ�¶Ȳ��䣬�ڸ������г���2.8molNH3��1.4molCO2������ƽ��ʱ��c��NH3��Ϊ___________��
��3���������£���0.5mol/L������Һ�м�������ˮ����ˮ�������c(H+)��c(OH��)_________�������������������С��������������
����֪Ksp��Ag2CrO4��=1.0��10��12����0.2mol/L��AgNO3��Һ�м���������0.00008mol/LK2CrO4��Һ������Һ�е�c(CrO42��)=___________��
�������£�0.1mol/LNaHCO3��Һ��pHֵ______0.1mol/LNa2SO3��Һ��pHֵ������>������<������=������֪��
H2CO3 | K1=4.3��10��7 | K2=5.6��10��11 |
H2SO3 | K1=1.54��10��2 | K2=1.02��10��7 |
��4����һ�ֿɳ����Na��Al/FeS����ع���ʱNa+�����ʵ������ֲ��䣬�������ú�Na+�ĵ��������Ϊ����ʣ���֪�õ��������ӦʽΪ2Na++FeS+2e��=Na2S+Fe����õ���ڳ��ʱ������������Ӧ��������____________���ŵ�ʱ������ӦʽΪ__________________��
���𰸡� BC 0.2mol/L ��С 1.0��10-10mol/L �� Na2S��Fe Na - e- = Na+
��������������������⿼��ƽ��ʱ��������С�ıȽϣ���ѧƽ��ļ��㣬Ӱ������ˮ������غ�����ˮ��Ĺ��ɣ��ܶȻ��ļ��㣬�ɳ���صĹ���ԭ����
��1�������з����ķ�ӦΪ2SO2��g��+O2��g��![]() 2SO3��g����A�������ҵ��ݻ���������������Һ���������ͬ�����ﵽ��ƽ��״̬��ͬ�����е�SO2���ʵ�������������ڴ�ƽ��ʱ�������СΪ1/2������ѹǿ��ƽ��������Ӧ�����ƶ���SO2���ʵ������٣���һ��ƽ��ʱ��SO2���ʵ������Ҹ��࣬A�����B��ͨ������δ��Ӧǰ���������������ʵ���Ϊ2mol+1mol+1mol=4mol���������������ʵ���Ϊ2mol�������ݻ�Ϊ���ҵ��������¶���ͬ��������ѹǿ������һ����B����ȷ��C�����Ҵ�����Ӧ��ʼ����ƽ�⣬����ƽ��ʱѹǿС��������ʼѹǿ�����Ҵ��淴Ӧ��ʼ����ƽ�⣬����ƽ��ʱѹǿ����������ʼʱѹǿ��������������ʼѹǿ��ȣ����һ��ƽ��ʱ������ѹǿһ��С�����ң�C����ȷ��D�������ݻ�Ϊ2�������ݻ�����������ʼ����4molSO2��2molO2����ͬ�����´ﵽƽ��ʱSO2���ʵ���Ϊ����SO2���ʵ�����2���������൱���ݻ�Ϊ1.5�������ݻ�����������ʼ����2molSO2��1molO2��2molSO3��g����1molAr����Ч���ݻ�Ϊ1.5�������ݻ�����������ʼ����4molSO2��2molO2��1molAr�������2�������ݻ���������С���������ѹǿ��ƽ��������Ӧ�����ƶ���SO2���ʵ�����С�����ڶ���ƽ��ʱ��SO2�������ʵ����ȵ�һ��ƽ��ʱ����SO2���ʵ�����2��Ҫ�٣�D�����ѡBC��
2SO3��g����A�������ҵ��ݻ���������������Һ���������ͬ�����ﵽ��ƽ��״̬��ͬ�����е�SO2���ʵ�������������ڴ�ƽ��ʱ�������СΪ1/2������ѹǿ��ƽ��������Ӧ�����ƶ���SO2���ʵ������٣���һ��ƽ��ʱ��SO2���ʵ������Ҹ��࣬A�����B��ͨ������δ��Ӧǰ���������������ʵ���Ϊ2mol+1mol+1mol=4mol���������������ʵ���Ϊ2mol�������ݻ�Ϊ���ҵ��������¶���ͬ��������ѹǿ������һ����B����ȷ��C�����Ҵ�����Ӧ��ʼ����ƽ�⣬����ƽ��ʱѹǿС��������ʼѹǿ�����Ҵ��淴Ӧ��ʼ����ƽ�⣬����ƽ��ʱѹǿ����������ʼʱѹǿ��������������ʼѹǿ��ȣ����һ��ƽ��ʱ������ѹǿһ��С�����ң�C����ȷ��D�������ݻ�Ϊ2�������ݻ�����������ʼ����4molSO2��2molO2����ͬ�����´ﵽƽ��ʱSO2���ʵ���Ϊ����SO2���ʵ�����2���������൱���ݻ�Ϊ1.5�������ݻ�����������ʼ����2molSO2��1molO2��2molSO3��g����1molAr����Ч���ݻ�Ϊ1.5�������ݻ�����������ʼ����4molSO2��2molO2��1molAr�������2�������ݻ���������С���������ѹǿ��ƽ��������Ӧ�����ƶ���SO2���ʵ�����С�����ڶ���ƽ��ʱ��SO2�������ʵ����ȵ�һ��ƽ��ʱ����SO2���ʵ�����2��Ҫ�٣�D�����ѡBC��
��2�������Ȼ�ѧ����ʽ��ÿ����2molNH3��1molCO2����Ӧ�ų�159.5kJ�������ų�127.6kJ����ʱn��NH3��ת��=![]() =1.6mol��n��CO2��ת��=
=1.6mol��n��CO2��ת��=![]() =0.8mol��ƽ��ʱn��NH3��=2mol-1.6mol=0.4mol��n��CO2��=1mol-0.8mol=0.2mol��ƽ��ʱc��NH3��=0.2mol/L��c��CO2��=0.1mol/L�����¶��»�ѧƽ�ⳣ��K=
=0.8mol��ƽ��ʱn��NH3��=2mol-1.6mol=0.4mol��n��CO2��=1mol-0.8mol=0.2mol��ƽ��ʱc��NH3��=0.2mol/L��c��CO2��=0.1mol/L�����¶��»�ѧƽ�ⳣ��K=![]() =
=![]() =250�����������г���2.8molNH3��1.4molCO2�������ʼ��ƽ��ת��CO2���ʵ���Ũ��Ϊx��������ʽ
=250�����������г���2.8molNH3��1.4molCO2�������ʼ��ƽ��ת��CO2���ʵ���Ũ��Ϊx��������ʽ
2NH3��g��+CO2��g��![]() NH2COONH4��s��
NH2COONH4��s��
c����ʼ����mol/L�� 1.4 0.7
c��ת������mol/L�� 2x x
c��ƽ�⣩��mol/L�� 1.4-2x 0.7-x
![]() =250�����x=0.6mol/L������ƽ��ʱ��c��NH3��=1.4mol/L-2
=250�����x=0.6mol/L������ƽ��ʱ��c��NH3��=1.4mol/L-2![]() 0.6mol/L=0.2mol/L��
0.6mol/L=0.2mol/L��
��3����Na2CO3��Һ����ǿ�������Σ���Һ��OH-ȫ������ˮ���룬ˮ�����c��H+��=c��OH-��������Һ�м�������ˮ���ٽ�CO32-��ˮ�⣬ˮ�����OH-���ʵ�������������Һ�������c��OH-����С������ˮ�������c��H+��![]() c��OH-����С��
c��OH-������
��n��AgNO3��![]() 0.00008V=0.19984V��c��Ag+������=
0.00008V=0.19984V��c��Ag+������=![]() =0.09992mol/L����Һ��c��CrO42-��=Ksp��Ag2CrO4��
=0.09992mol/L����Һ��c��CrO42-��=Ksp��Ag2CrO4��![]() c2��Ag+��=1
c2��Ag+��=1![]() 10-12
10-12![]() 0.099922=1.0
0.099922=1.0![]() 10-10��mol/L����
10-10��mol/L����
��HCO3-��ˮ��ƽ��Ϊ��HCO3-+H2O![]() H2CO3+OH-��HCO3-��ˮ��ƽ�ⳣ��Kh=
H2CO3+OH-��HCO3-��ˮ��ƽ�ⳣ��Kh=![]() =
=![]() =
=![]() =
=![]() =2.3
=2.3![]() 10-8
10-8![]() 5.6
5.6![]() 10-11��HCO3-��ˮ��̶ȴ���HCO3-�ĵ���̶ȣ�NaHCO3��Һ�ʼ��ԣ�H2CO3��K1
10-11��HCO3-��ˮ��̶ȴ���HCO3-�ĵ���̶ȣ�NaHCO3��Һ�ʼ��ԣ�H2CO3��K1![]() H2SO3��K2��HCO3-��ˮ������
H2SO3��K2��HCO3-��ˮ������![]() SO32-��ˮ��������0.1mol/LNaHCO3��Һ��pHֵ
SO32-��ˮ��������0.1mol/LNaHCO3��Һ��pHֵ![]() 0.1mol/LNa2SO3��Һ��pHֵ��
0.1mol/LNa2SO3��Һ��pHֵ��
��4�����������ӦʽΪ2Na++FeS+2e-=Na2S+Fe����س��ʱ������ӦʽΪNa2S+Fe-2e-=FeS+2Na+�����ʱ����������Ӧ��������Na2S��Fe�����������ӦʽΪ2Na++FeS+2e-=Na2S+Fe����������Na+����ع���ʱNa+�����ʵ������ֲ��䣬���ظ�����ӦʽΪNa-e-=Na+��

 ��һ����ͬ���ɽ�����ϵ�д�
��һ����ͬ���ɽ�����ϵ�д� ������Ӧ���ϵ�д�
������Ӧ���ϵ�д� ��ʦ�㾦�ִʾ��ƪϵ�д�
��ʦ�㾦�ִʾ��ƪϵ�д�