题目内容
【题目】离子交换法制取纯净水的过程如下图所示。
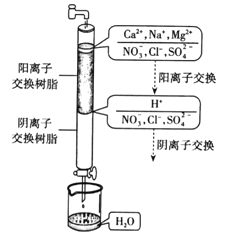
请根据图示回答下列问题:
(1)若水龙头中出来的是硬水,则其中含有较多的___离子。
(2)阳离子交换树脂中所含的大量阳离子是___,根据电荷守恒可知,通过阳离子交换树脂后,水中阳离子的数目___(填“增多”、“减少”或“不变”)。
(3)水中的NO3、Cl、SO42,通过阴离子交换树脂转化为___离子,进而与H+反应生成H2O,有关反应的离子方程式为___。
(4)通过净化处理后,水的导电能力___(填“增强”、“减弱”或“不变”),原因是____。
【答案】Ca2+、Mg2+ H+ 增多 OH- H++ OH-=H2O 减弱 水中的离子浓度减小
【解析】
(1)根据硬水的概念分析判断;
(2)根据图示,结合水经过阳离子交换树脂成分的变化分析判断;
(3)根据图示,经过阴离子交换树脂水的成分的变化分析解答;
(4)导电能力与溶液中的离子浓度的大小有关,据此分析解答。
(1)硬水是指含有较多可溶性钙、镁化合物的水,则其中含有较多的Ca2+、Mg2+,故答案为:Ca2+、Mg2+;
(2)根据图示,阳离子交换树脂中所含的大量阳离子是H+,经过阳离子交换树脂后,硬水中的Ca2+、Mg2+、Na+被H+代替,根据电荷守恒可知,通过阳离子交换树脂后,水中阳离子的数目增多,故答案为:H+;增多;
(3)根据图示,水中的NO3、Cl、SO42,通过阴离子交换树脂转化为OH-离子,进而与H+反应生成H2O,反应的离子方程式为H++ OH-=H2O,故答案为:OH-;H++ OH-=H2O;
(4)通过净化处理后,水中的离子浓度减小,导电能力减弱,故答案为:减弱;水中的离子浓度减小。

练习册系列答案
相关题目