题目内容
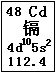
近期曝出的“毒大米”事件,引起了国人的震惊和忧虑,又一次把环境问题摆在了我们面前。“毒大米”是由镉污染引起的,会对人体健康造成严重危害。镉元素在元素周期表中的图示如图所示。
请回答下列问题:
(1)镉元素的原子序数为 ,在元素周期表中的位置是 。
(2)有人说:“‘毒大米’中镉的含量很低,每人每天食用大米量也较少,所以,不会对人体健康造成严重危害。”你对这种说法有何评论? 。
(3)你认为“毒大米”中镉的来源是什么? 。
(4)镉也是生产电池的重要材料,镉镍二次电池(碱性)的放电和充电反应为:
Cd + 2NiO(OH) + 2H2O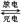 Cd(OH)2+ 2Ni(OH)2
Cd(OH)2+ 2Ni(OH)2
电池的负极是 。
负极的电极反应式为 。
若负极消耗a g反应物,产生N个电子的电量,则阿伏加德罗常数NA= 。

请回答下列问题:
(1)镉元素的原子序数为 ,在元素周期表中的位置是 。
(2)有人说:“‘毒大米’中镉的含量很低,每人每天食用大米量也较少,所以,不会对人体健康造成严重危害。”你对这种说法有何评论? 。
(3)你认为“毒大米”中镉的来源是什么? 。
(4)镉也是生产电池的重要材料,镉镍二次电池(碱性)的放电和充电反应为:
Cd + 2NiO(OH) + 2H2O
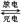 Cd(OH)2+ 2Ni(OH)2
Cd(OH)2+ 2Ni(OH)2电池的负极是 。
负极的电极反应式为 。
若负极消耗a g反应物,产生N个电子的电量,则阿伏加德罗常数NA= 。
(9分) (1)48(1分) 第五周期第ⅡB族(1分)
(2)长期食用“毒大米”会使镉在人体内累积增多,最终仍然会对人体健康造成严重危害。(1分)
(3)工业生产造成了土壤的镉污染,富集在大米中(1分)
(4)Cd(镉)(1分) Cd-2e—+2OH—=Cd(OH)2(2分)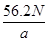 mol—1(2分)
mol—1(2分)
(2)长期食用“毒大米”会使镉在人体内累积增多,最终仍然会对人体健康造成严重危害。(1分)
(3)工业生产造成了土壤的镉污染,富集在大米中(1分)
(4)Cd(镉)(1分) Cd-2e—+2OH—=Cd(OH)2(2分)
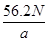 mol—1(2分)
mol—1(2分)试题分析:(1)镉元素在元素周期表中的图示可知,镉元素的原子序数为48,在元素周期表中的位置是第五周期第ⅡB族。
(2)长期食用“毒大米”会使镉在人体内累积增多,最终仍然会对人体健康造成严重危害,所以这种说法是错误的。
(3)“毒大米”中镉的来源是工业生产造成了土壤的镉污染,富集在大米中。
(4)放电相当于是原电池,原电池中负极失去电子,化合价升高,发生氧化反应。所以根据化学方程式可知,该电池的负极是Cd,负极电极反应式是Cd-2e—+2OH—=Cd(OH)2。agCd的物质的量是
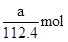 ,在反应中失去
,在反应中失去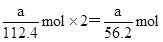 电子,所以阿伏加德罗常数NA=
电子,所以阿伏加德罗常数NA=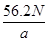 mol—1。
mol—1。点评:该题以近期曝出的“毒大米”事件为载体,重点考查学生对元素周期表结构、原电池原理以及灵活运用基础知识解决实际问题的能力的培养,有利于调动学生的学习兴趣,激发学生的学习积极性。也有助于培养学生的环境保护意识,增强学生的社会责任感。

练习册系列答案
相关题目

 -NMR(核磁共振)可以用于含碳化合物的结构分析。
-NMR(核磁共振)可以用于含碳化合物的结构分析。