题目内容
在500 mL 0.1 mol?L-1的FeCl2溶液中,通入一定量Cl2,待反应结束后,将溶液稀释到1 L,再取出1/10稀溶液,加入足量的AgNO3溶液,共得到2.009 g沉淀。问:原溶液中的Fe2+是否完全被氧化?若未完全氧化,试求Fe2+被氧化的质量分数(不考虑Cl2与H2O的反应)。
否 80%
设被氧化的Fe2+的物质的量为x。
2Fe2++Cl2══2Fe3++2Cl-
2 mol 2 mol
x (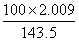 mol-0.1×0.5×2 mol)
mol-0.1×0.5×2 mol)
x="0.04" mol
被氧化的Fe2+∶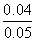 ×100%=80%
×100%=80%
剩余的Fe2+∶ 0.1 mol·L-1×0.5 L-0.04 mol=0.01 mol
2Fe2++Cl2══2Fe3++2Cl-
2 mol 2 mol
x (
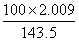 mol-0.1×0.5×2 mol)
mol-0.1×0.5×2 mol)x="0.04" mol
被氧化的Fe2+∶
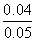 ×100%=80%
×100%=80%剩余的Fe2+∶ 0.1 mol·L-1×0.5 L-0.04 mol=0.01 mol

练习册系列答案
相关题目

