题目内容
亚硫酰氯(SOCl2)是重要的有机物卤化剂和电池的介质,生产上和生活中有着广泛应用,亚硫酰氯易水解,在140℃以上可发生:4SOCl2=3Cl2↑+2SO2↑+S2Cl2。有关说法不正确的是
抑制氯化锌的水解
| A.1mol SOCl2受热分解,转移2mol电子 |
| B.S2Cl2分子中各原子均达到八电子结构 |
| C.气态产物通入品红溶液中,一定能使品红溶液褪色 |
| D.工业上用ZnCl2·6H2O与SOCl2混合制无水氯化镁,是利用SOCl2水解释放出HCl, |
D
SOCl2中硫元素的化合价为+4价,氯元素为-1价,据反应方程式可知,1mol SOCl2受热分解,转移6 mol电子,故A错误;S2Cl2分子的结构可以类比过氧化氢,等物质的量的氯气和二氧化硫可以恰好与水反应,反应后氯气剩余,故C正确。

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
 ①
①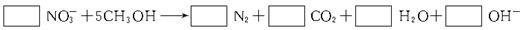
 CuSO4+SO2↑+2H2O,对于该反应,下列说法中不正确的是
CuSO4+SO2↑+2H2O,对于该反应,下列说法中不正确的是 中,当有1.5摩铜被氧化时 ( )
中,当有1.5摩铜被氧化时 ( )