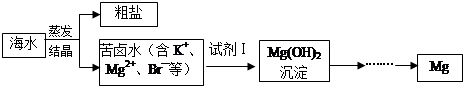题目内容
有三瓶标签脱落的无色透明溶液,分别是稀盐酸、稀硫酸和稀硝酸。请你帮助实验老师设计两种方法鉴别它们。
| | 操 作 步 骤 | 现 象 及 结 论 |
| 方法一 | | |
| 方法二 | | |
操 作 步 骤 现 象 及 结 论 方法一 (1)各取少量溶液于试管中,分别滴加BaCl2溶液(2)各取剩余的两种溶液于试管中,分别滴加AgNO3溶液 (1)产生白色沉淀的是稀硫酸(2)产生白色沉淀的是稀盐酸,剩余的是稀硝酸 方法二 (1)各取少量溶液于试管中,分别加入铜片
(2)各取剩余的两种溶液于试管中,分别滴加BaCl2溶液有气泡产生的是稀硝酸
产生白色沉淀的是稀硫酸,剩余的是稀盐酸
解析试题分析:据盐酸与硝酸银反应生成难溶于水的AgCl沉淀,硫酸与BaCl2反应生成BaSO4沉淀,以及硝酸具有强氧化性可设计两种实验方案:方案一:可加入BaCl2溶液鉴别出稀硫酸,再加入AgNO3溶液,生成沉淀的为盐酸;方案二:根据硝酸具有强氧化性,与铜反应生成NO气体,剩余两种溶液加入BaCl2溶液,生成沉淀的是硫酸.
考点:物质的检验和鉴别的实验方案设计;常见阴离子的检验

 阅读快车系列答案
阅读快车系列答案除去下列物质中所含少量杂质,填写所选用的试剂和分离方法
| | 混合物 (括号内为少量杂质) | 试剂 (足量) | 分离方法 |
| A | 苯(苯酚) | | |
| B | 乙烯(SO2) | | |
| C | 乙酸乙酯(乙酸) | | |
| D | 乙醇(水) | | |
(16分)某同学从网络上了解到菠菜中富含可溶性的两类正盐:草酸盐和碳酸盐。该同学欲用实验验证这一事实并检测其中草酸盐的含量。查阅资料得知草酸(H2C2O4)是一种二元有机弱酸,具有较强的还原性;草酸钙(CaC2O4)不溶于水能溶于稀硫酸。请回答下列问题:
(1)该学生将菠菜研磨成粉末、热水浸泡、过滤得到澄清溶液A。研磨菠菜使用的实验仪器的名称为 。
(2)设计实验方案验证菠菜中含有草酸盐和碳酸盐,补充完成预期现象和结论。
| 实验步骤 | 预期现象和结论 |
| 步骤1:调节溶液A至弱碱性,滴加足量CaCl2溶液。 | ①出现白色沉淀,说明菠菜中 。 |
| 步骤2:取步骤1的沉淀于试管中,加入足量的稀硫酸,沉淀完全溶解,并将产生的无色无味的气体通入澄清石灰水中。 | ② 。 |
| 步骤3:向步骤2得到的溶液中滴加几滴高锰酸钾溶液。 | ③ 。 |
①操作:取m g菠菜样品,将其中草酸盐全部转化为CaC2O4沉淀分离出来置于烧杯中,用过量的稀硫酸完全溶解后,溶液转入 中并加水配制成250mL溶液。每次移取25.00mL该溶液于锥形瓶中,用0.0100mol·L-1 KMnO4标准溶液滴定,平均消耗标准溶液V mL。KMnO4滴定实验时发生的离子方程式为 。
②计算:菠菜中草酸盐(以C2O42-计算)的质量分数为(可以只列式不化简) 。
③误差分析: 下列操作会使测定结果偏高的是 。
A.配制溶液时未洗涤烧杯和玻璃棒就加水定容
B.锥形瓶未干燥就加入待测液进行滴定
C.未用标准液润洗就加入标准液开始滴定
D.滴定前尖嘴处有气泡滴定后气泡消失
E.滴定后俯视读数
(15分)CoCl2·6H2O是一种饲料营养强化剂。一种利用水钻矿(主要成分为CO2O3、Co
(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:
已知:①浸出液含有的阳离了主要有H+、CO2+、Fe2+、Mn2+、Al3+等:
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01 mo1·L-l)
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式 。
(2)写出NaC1O3发生反应的主要离子方程式 ;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式 。
(3)“加Na2CO3调pH至a'’,过滤所得到的沉淀成分为____ 。
(4)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是 :其使用的最佳pH范围是____ 。
| A.2.0~2.5 | B.3.0~3.5 | C.4.0~4.5 | D.5.0~5.5 |
(6)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是 。(答一条即可)

 ZnFe2(C2O4)3·6H2O↓……………(a)
ZnFe2(C2O4)3·6H2O↓……………(a) ZnFe2O4+2CO2↑+4CO↑+6H2O ……………(b)
ZnFe2O4+2CO2↑+4CO↑+6H2O ……………(b)