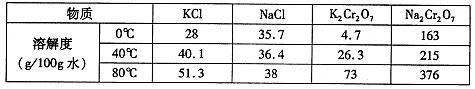
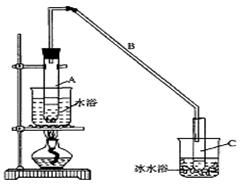
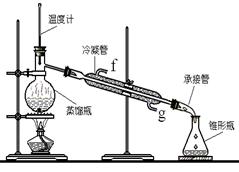
题目内容
除去下列物质中所含少量杂质,填写所选用的试剂和分离方法
| | 混合物 (括号内为少量杂质) | 试剂 (足量) | 分离方法 |
| A | 苯(苯酚) | | |
| B | 乙烯(SO2) | | |
| C | 乙酸乙酯(乙酸) | | |
| D | 乙醇(水) | | |
混合物 试剂(足量) 分离方法 A 苯(苯酚) NaOH溶液 分液 B 乙烯(SO2) NaOH溶液 洗气 C 乙酸乙酯(乙酸) 饱和Na2CO3溶液 分液 D 乙醇(水) CaO固体 蒸馏
解析试题分析:A、苯酚具有酸性,能与氢氧化钠反应,形成两层通过分液除去;B、SO2与碱反应,乙烯不反应,通过氢氧化钠溶液洗去SO2;C、饱和Na2CO3溶液与乙酸反应,同时降低乙酸乙酯的溶解度,利于分层,通过分液分离;D、用CaO固体与水反应,固定水采用蒸馏的方法收集乙醇。
考点:考查实验中除杂有关问题。

练习册系列答案
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的工艺流程如下: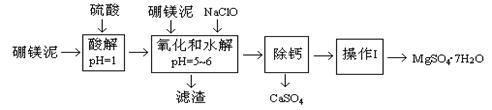
已知:NaClO与Mn2+反应产生MnO2沉淀。
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 7.6 |
| 完全沉淀pH | 4.1 | 5.2 | 9.6 |
根据题意回答下列问题:
(1)实验中需用1.00mol/L的硫酸80.0mL,若用98%的浓硫酸配制,除量筒、玻璃棒、胶头滴管外,还需要的玻璃仪器有 、 。
(2)滤渣的主要成份除含有Fe(OH)3、Al(OH)3外,还有 、 。
(3)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式: 。
在调节pH=5~6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为:
。
(4)为了检验滤液中Fe3+是否被除尽,可选用的试剂是 。
A.KSCN溶液 B.淀粉KI溶液 C.H2O2 D.KMnO4稀溶液
(5)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
(6)如果测得提供的硼镁泥的质量为100.0g,得到的MgSO4·7H2O196.8g,则MgSO4·7H2O的产率为 (相对分子质量:MgSO4·7H2O-246 MgO-40)。
有三瓶标签脱落的无色透明溶液,分别是稀盐酸、稀硫酸和稀硝酸。请你帮助实验老师设计两种方法鉴别它们。
| | 操 作 步 骤 | 现 象 及 结 论 |
| 方法一 | | |
| 方法二 | | |
多彩水泥的添加剂是CoCl2-6H2O。工定是以含钴废料(含少量Fe、Al等杂质制取CoCl2·6H2O的一种新工艺流程如下图:
已知:①钴与盐酸反应的化学方程式为:Co+2HCl CoCl2+H2↑
②CoCl2·6H2O溶点86oC,易溶于水、乙醚等;常温下稳定无毒,加热至110oC~120OC时,失去结晶水变成有毒的无水氯化钴。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
请回答下列问题:
(1)上述流程中的试剂a可能为 ;其作用是 ;
(2)加入碳酸钠调节pH至b,b的范围是 ;
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
(3)操作1是 ;滤渣的成分为 ;
(4)操作2的过程为蒸发浓缩、 和过滤。
(5)制得的CoCl2·6H2O需减压烘干的原因是 。
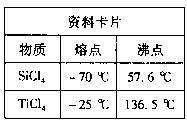
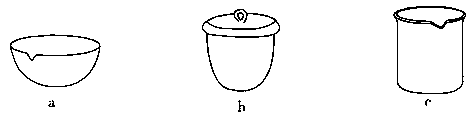
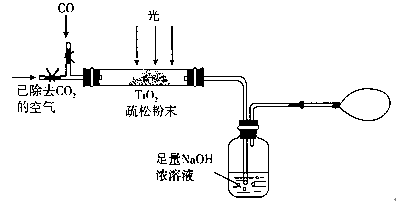

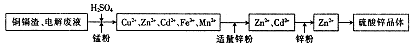
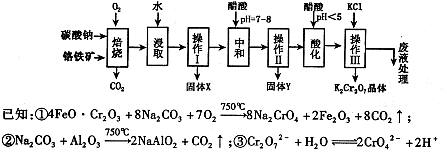
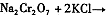
 。该反应在溶液中能发生的理由是: 。
。该反应在溶液中能发生的理由是: 。