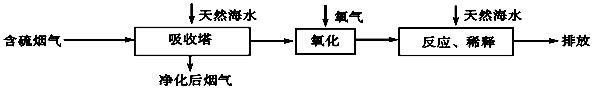
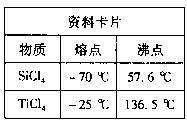
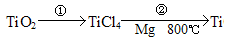题目内容
氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇,熔点422 ℃,沸点1366 ℃,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。以粗盐水(含Ca2+、Mg2+、SO42-等杂质)、Cu、稀硫酸、SO2等为原料合成CuCl的工艺如下:
(1)在粗盐除杂的反应I中加Na2CO3溶液的作用是 ;
滤渣的主要成分: 。
(2)反应Ⅱ完成后溶液中主要溶质是 。
(3)反应IV和VI都是制备CuCl的化学过程:
①反应IV加入的Cu必须过量,其目的是 。
②写出反应VI的离子方程式 。
(4)反应VI后,过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70 ℃干燥2小时,冷却,密封包装即得产品。于70℃真空干燥的目的是 。
(1)除去Ca2+和过量的Ba2+ BaSO4、CaCO3、Mg(OH)2、BaCO3 (2)NaCl
(3)防止生成CuCl2 2Cu2++2Cl-+SO2+2H2O = 2CuCl↓+4H++SO42-
(4)加快乙醇和水的蒸发,防止CuCl被空气氧化
解析试题分析:(1)分析流程图知,反应Ⅰ为粗盐的提纯,为保证杂质离子除尽所加试剂要过量,加过量氯化钡溶液除硫酸根,加过量Na2CO3溶液可以粗盐溶液中的除去Ca2+和除去硫酸根离子所加的过量的Ba2+,加过量氢氧化钠溶液除镁离子;答案为:除去Ca2+和过量的Ba2+;(2)分析流程图知,反应Ⅱ完成后溶液中主要溶质是氯化钠;(3)①反应Ⅳ加入的Cu必须过量,金属铜可以和铜离子在溶液中生成亚铜离子,这样可以防止生成CuCl2;②二氧化硫和硫酸铜之间可以发生氧化还原反应生成氯化亚铜沉淀,反应的离子方程式为2Cu2++2Cl-+SO2+2H2O = 2CuCl↓+4H++SO42-;(4)根据题给信息知,氯化亚铜(CuCl)在空气中迅速被氧化成绿色,CuCl沉淀在真空干燥机内于70℃干燥2小时的目的是加快乙醇和水的蒸发,防止CuCl被空气氧化。
考点:考查物质的分离、提纯和制备,离子方程式的书写。

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。目前我国已经在技术上取得突破——从硫酸渣中分离出各种成分并加以利用。其流程和相关数据如下: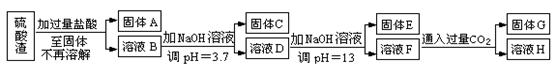
查资料得知:
| 物质名称 | 溶度积(Ksp) | pH值 | |
| 开始沉淀 | 完全沉淀 | ||
| Mg(OH)2 | 5.6×10-12 | 9.3 | 10.8 |
| Fe(OH)3 | 2.8×10-16 | 2.7 | 3.7 |
| Al(OH)3 | 1.3×10-33 | 3.7 | 4.7 |
请回答下列问题:
(1)写出固体A的化学式为 。
(2)若要测定溶液的pH是否达到3.7,下列实验用品中可选用的是 。
A.石蕊试液 B.广泛pH试纸 C.精密pH试纸 D.pH计
(3)完成下列离子反应方程式
①溶液D生成固体E ; ②溶液F生成固体G 。
(4)要将固体C、固体E和固体G都转化为相应的稳定氧化物,需进行的实验操作为 。
(5)若不考虑溶液体积的变化,请计算溶液H中c(Mg2+)= 。
工业上用闪锌矿(主要成分为ZnS,还含有Fe2O3等杂质)为原料生产ZnSO4·7H2O的工艺流程如下: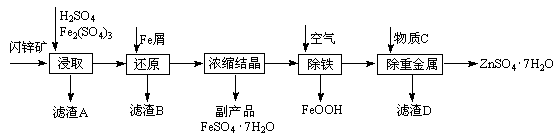
(1)从滤渣A中可获得一种淡黄色非金属单质的副产品,其化学式为 。
(2)浸取过程中Fe2(SO4)3的作用是 ,浸取时Fe2(SO4)3与ZnS发生反应的化学方程式为 。
(3)除铁过程控制溶液的pH在5.4左右,该反应的离子方程式为 。该过程在空气入口处设计了一个类似淋浴喷头的装置,其目的是 。
(4)置换法除重金属离子所用物质C为 。
(5)硫酸锌的溶解度与温度之间的关系如下表:
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
从除重金属后的硫酸锌溶液中获得硫酸锌晶体的实验操作为 、 、过滤、干燥。
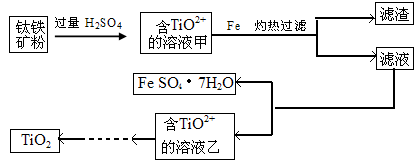
某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿(主要成份:CuO ZnO)的方案,实现废物综合利用,方案如下图所示。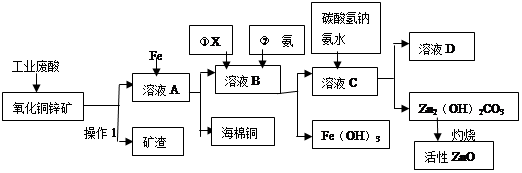
请回答下列问题:
(1)操作1的名称是:
(2)向溶液A中加入Fe粉发生的主要的反应离子方程式为: 、 。
(3)向溶液B中加入物质X的目的是 ,物质X可用下列物质中的 。(填字母)
| A.KMnO4 | B.O2 | C.H2O2 | D.NaOH |
(5)溶液D中主要溶质的化学式是 。
(6)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:Ksp(CuS) Ksp(ZnS)(选填“>”“<”或“=”)。
有三瓶标签脱落的无色透明溶液,分别是稀盐酸、稀硫酸和稀硝酸。请你帮助实验老师设计两种方法鉴别它们。
| | 操 作 步 骤 | 现 象 及 结 论 |
| 方法一 | | |
| 方法二 | | |