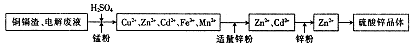��Ŀ����
����п��ZnFe2O4���ǶԿɼ������еİ뵼���������ʵ�����Ʊ�ԭ��Ϊ��
Zn2++2Fe2++3C2O42��+6H2O ZnFe2(C2O4)3��6H2O������������(a)
ZnFe2(C2O4)3��6H2O������������(a)
ZnFe2(C2O4)3��6H2O  ZnFe2O4+2CO2��+4CO��+6H2O ����������(b)
ZnFe2O4+2CO2��+4CO��+6H2O ����������(b)
��1�������Ʊ�ԭ��������������ԭ��Ӧ���� ��ѡ���a����b������
��2���Ʊ�ZnFe2(C2O4)3��6H2Oʱ����ѡ�õ�ҩƷ�У�
��(NH4)2Fe(SO4)2��6H2O����ZnSO4��7H2O����(NH4)2C2O4��7H2O��
�ٳ���ҩƷʱ�������ϸ����n(Fe2+)/n(Zn2+)= ��
��ѡ�õļ��Ϸ�ʽ�� (����ĸ)��
a����һ�������ȣ���ͬʱ���뷴Ӧ������ˮ���裬Ȼ��������75�档
b����һ�������ȣ���ͬʱ���뷴Ӧ����ˮ�����Һ��Ȼ������Ȼ�����µ�75�档
c����һ�������ȣ������ϲ������Һ�ף��������������Һ�ң��ס���ͬʱ���ȵ�75�棬Ȼ������Һ�����������Һ�У����������衣
��3������Һ�з����ZnFe2(C2O4)3��6H2O����ˡ�ϴ�ӡ���ϴ����ȫ�������� ��
��4��ZnFe2(C2O4)3��6H2O�ȷֽ����þƾ���ƣ����õ��Ĺ������������� �� ��
��5��ij��ѧ����С�����÷Ͼɸɵ��пƤ�������������������ͼ��Ϣ����ʵ����ṩ���Լ���ȡ������ZnSO4��Һ��
ʵ���п�ѡ�õ��Լ����£�
��a��30%H2O2����b��������ˮ��
��c��1.0 mol��L��1NaOH��Һ��
��d��3mol��L-1ϡ���
��e����ZnO��ĩ��
��f����п�ۡ�
ʵ�鲽������Ϊ���ٽ�пƬ��ȫ�����Թ�����3mol��L��1ϡ���ᣬ���� ��ѡ����ĸ����ͬ�����ڼ��� ���ۼ��ȵ�60�����Ҳ����Ͻ��裻
�ܹ��˵�ZnSO4��Һ�����в���ۼ��ȵ���ҪĿ���� ��
��1��b
��2����2:1 ��c
��3��ȡ���һ��ϴ��Һ������1-2�������ữ���Ȼ�����Һ���������ְ�ɫ��������ʾ�Ѿ�ϴ����ȫ��
��4�������������ǡ�
��5���� a(ad)����c���ٽ�����������ˮ��ת��Ϊ������ʹ�����Ĺ��������ȥ��
���������������1��a����Ԫ�صĻ��ϼ�û�з����仯��b����Ԫ�ػ��ϼ۱仯�ˣ���ѡb����2���Ʊ�ZnFe2(C2O4)3��6H2Oʱ����ѡ�õ�ҩƷ�У���(NH4)2Fe(SO4)2��6H2O����ZnSO4��7H2O����(NH4)2C2O4��7H2O���ٸ��ݻ�ѧʽZnFe2(C2O4)3��6H2O���ڻ�ѧʽ��n(Fe2+)/n(Zn2+)=1��2������ҩƷʱ�������ϸ����n(Fe2+)/n(Zn2+)=1��2����ѡ�õļ��Ϸ�ʽ��c����һ�������ȣ������ϲ������Һ�ף��������������Һ�ң��ס���ͬʱ���ȵ�75�棬Ȼ������Һ�����������Һ�У����������衣��3���ж�ϴ��Һ��ϴ����ȫ����������Ҫ�Ǽ�������ڱ�������ӣ����ܼ�˵��û��ϴ�ɾ������巽�����£�ȡ���һ��ϴ��Һ������1-2�������ữ���Ȼ�����Һ���������ְ�ɫ��������ʾ�Ѿ�ϴ����ȫ����4��ZnFe2(C2O4)3��6H2O�ȷֽ����þƾ���ƣ�˵���ֽ�ʱ���¶ȱȽϸߣ���Ҫ���������н��У����õ������ǡ���5�����ڷϾɸɵ��пƤ����������������ȡ������ZnSO4��Һ�����ȥ���������ӣ����ã�a��30%H2O2�����������ټ��봿ZnO��ĩ����PH���������������ӣ����ȵ�60�����Ҳ����Ͻ��裻��ҪĿ�����ö���Ĺ�������ֽ��Լ���Ѹ���������ӵ�ˮ�����ɳ����Ա��ȥ��
���㣺����ͬѧ�ǽ������Ϣ��������û�ѧʽ���йؼ�����з������⡢��������������

���������û�������������������ų��ķ�������Ҫ��ѧ�ɷ�ΪSiO2Լ45%��Fe2O3Լ40%��Al2O3Լ10%��MgOԼ5%��Ŀǰ�ҹ��Ѿ��ڼ�����ȡ��ͻ�ơ������������з�������ֳɷֲ��������á������̺�����������£�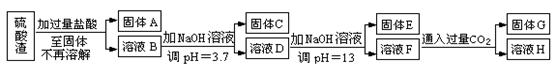
�����ϵ�֪��
| �������� | �ܶȻ�(Ksp) | pHֵ | |
| ��ʼ���� | ��ȫ���� | ||
| Mg(OH)2 | 5.6��10��12 | 9.3 | 10.8 |
| Fe(OH)3 | 2.8��10��16 | 2.7 | 3.7 |
| Al(OH)3 | 1.3��10��33 | 3.7 | 4.7 |
��ش��������⣺
��1��д������A�Ļ�ѧʽΪ ��
��2����Ҫ�ⶨ��Һ��pH�Ƿ�ﵽ3.7������ʵ����Ʒ�п�ѡ�õ��� ��
A��ʯ����Һ B���㷺pH��ֽ C������pH��ֽ D��pH��
��3������������ӷ�Ӧ����ʽ
����ҺD���ɹ���E �� ����ҺF���ɹ���G ��
��4��Ҫ������C������E����G��ת��Ϊ��Ӧ���ȶ����������е�ʵ�����Ϊ ��
��5������������Һ����ı仯���������ҺH��c��Mg2����= ��
ij����С����Ƴ����ù�ҵ���ᣨ10%H2SO4�����ѽ�ij����������ͭп����Ҫ�ɷݣ�CuO ZnO���ķ�����ʵ�ַ����ۺ����ã���������ͼ��ʾ��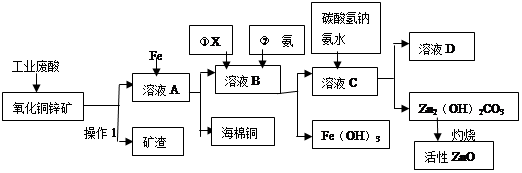
��ش��������⣺
��1������1�������ǣ�
��2������ҺA�м���Fe�۷�������Ҫ�ķ�Ӧ���ӷ���ʽΪ�� �� ��
��3������ҺB�м�������X��Ŀ���� ������X�������������е� ��(����ĸ)
| A��KMnO4 | B��O2 | C��H2O2 | D��NaOH |
��5����ҺD����Ҫ���ʵĻ�ѧʽ�� ��
��6������ͭп���к���������CuS��ZnS����H2SO4��������ZnS�����ܽ��CuS���ܣ�����ͬ�¶��£�Ksp(CuS) Ksp(ZnS)��ѡ�������������������
��þ����һ�ֹ�ҵ���ϣ���Ҫ�ɷ���MgO(ռ40%)������CaO��MnO��Fe2O3��FeO��Al2O3��SiO2�����ʣ��Դ�Ϊԭ����ȡ������þ��������ӡȾ����ֽ��ҽҩ�ȹ�ҵ������þ������ȡMgSO4��7H2O�Ĺ����������£�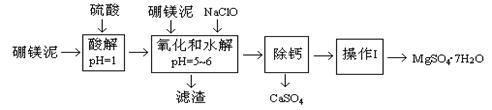
��֪��NaClO��Mn2+��Ӧ����MnO2������
| ������ | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| ��ʼ����pH | 2.3 | 4.0 | 7.6 |
| ��ȫ����pH | 4.1 | 5.2 | 9.6 |
��������ش��������⣺
(1)ʵ��������1.00mol/L������80.0mL������98%��Ũ�������ƣ�����Ͳ������������ͷ�ι��⣬����Ҫ�IJ��������� �� ��
(2)��������Ҫ�ɷݳ�����Fe(OH)3��Al(OH)3�⣬���� �� ��
(3)�����NaClO����Mn2+��Ӧ����MnO2�������÷�Ӧ�����ӷ���ʽ�� ��
�ڵ���pH��5��6֮ǰ������һ������Ҳ�ᱻNaClO�������÷�Ӧ�����ӷ���ʽΪ��
��
(4)Ϊ�˼�����Һ��Fe3+�Ƿ�������ѡ�õ��Լ��� ��
A��KSCN��Һ B������KI��Һ C��H2O2 D��KMnO4ϡ��Һ
(5)��֪MgSO4��CaSO4���ܽ�����±���
| �¶ȣ��棩 | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
(6)�������ṩ����þ�������Ϊ100.0g���õ���MgSO4��7H2O196.8g����MgSO4��7H2O�IJ���Ϊ (��Է���������MgSO4��7H2O��246 MgO��40)��
����ƿ��ǩ�������ɫ����Һ���ֱ���ϡ���ᡢϡ�����ϡ���ᡣ�������ʵ����ʦ������ַ����������ǡ�
| | �� �� �� �� | �� �� �� �� �� |
| ����һ | | |
| ������ | | |
��17�֣���2012?�㶫��������㷺Ӧ������ҩ�ͻ�����ҵ��ijͬѧ�����üױ���������Ӧ�Ʊ������ᣬ��Ӧԭ����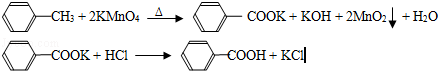
ʵ�鷽����һ�����ļױ���KMnO4��Һ��100�淴Ӧһ��ʱ���ֹͣ��Ӧ�����������̷����������ͻ���δ��Ӧ�ļױ���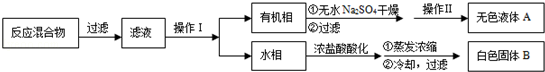
��֪�������������122���۵�122.4�棬��25���95��ʱ�ܽ�ȷֱ�Ϊ0.3g��6.9g�����������л��ﶼ�й̶��۵㣮
��1���������� ������������ ����
��2����ɫҺ��A���� �������Լ���A���Լ����� ������������
��3���ⶨ��ɫ����B���۵㣬��������115�濪ʼ�ۻ����ﵽ130��ʱ�����������ۣ���ͬѧ�Ʋ��ɫ����B�DZ�������KCl�Ļ�����������·��������ᴿ�ͼ��飬ʵ���������Ʋ���ȷ�����ڴ������ɱ������ݣ�
| ��� | ʵ�鷽�� | ʵ������ | ���� |
| �� | ����ɫ����B����ˮ�У������ܽ⣬��_________�� ��_________�� | �õ���ɫ�������ɫ��Һ | |
| �� | ȡ������Һ���Թ��У���_________�� | ���ɰ�ɫ���� | ��Һ��Cl�� |
| �� | �����ɫ���壬��_________�� | ��_________�� | ��ɫ�����DZ����� |