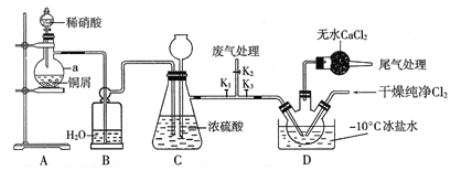
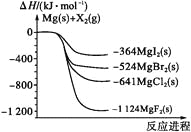
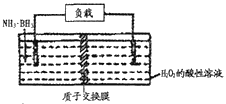
题目内容
【题目】将4.34 g Na、Na2O、Na2O2的混合物与足量的水反应,在标准状况下得到672 mL混合气体,将混合气体通电后恰好完全反应,则Na、Na2O、Na2O2的物质的量之比为
A. 4∶3∶2 B. 1∶2∶1 C. 1∶1∶2 D. 1∶1∶1
【答案】A
【解析】
试题Na、Na2O、Na2O2的混合物与足量的水反应得到的气体是氢气和氧气的混合物,将该混合气体通过放电,恰好完全反应,说明氢气和氧气反应的物质的量之比恰好等于它们反应的计量数之比,氢气来源于钠和水的反应,氧气来源于过氧化钠与水的反应,通过钠与水、过氧化钠与水、氢气和氧气反应的方程式,找出钠与过氧化钠的物质的量之比,直接核对选项即可得答案.(针对选择题)
钠与水、过氧化钠与水、氢气与氧气的反应方程式如下: 2Na+2H2O=2NaOH+H2↑钠与氢气的关系式为2Na--H2,2Na2O2+2H2O=4NaOH+O2↑过氧化钠与氧气的关系式为 2Na2O2--O2,2H2+O2![]() 2H2O,氢气和氧气的关系式为2H2--O2,将该混合气体通过放电,恰好完全反应,说明氢气和氧气反应的物质的量之比恰好等于它们反应的计量数之比,即氢气和氧气的物质的量之比为2:1,通过钠与氢气、过氧化钠与氧气、氢气与氧气的关系式可得钠与过氧化钠的关系式为:4Na--2H2--O2--2Na2O2,所以钠与过氧化钠的物质的量之比为4:2。
2H2O,氢气和氧气的关系式为2H2--O2,将该混合气体通过放电,恰好完全反应,说明氢气和氧气反应的物质的量之比恰好等于它们反应的计量数之比,即氢气和氧气的物质的量之比为2:1,通过钠与氢气、过氧化钠与氧气、氢气与氧气的关系式可得钠与过氧化钠的关系式为:4Na--2H2--O2--2Na2O2,所以钠与过氧化钠的物质的量之比为4:2。

练习册系列答案
相关题目