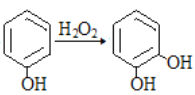
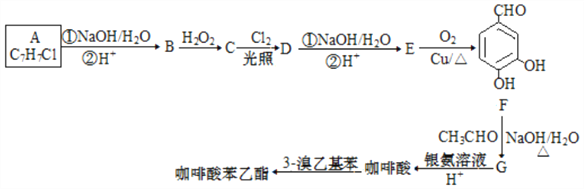
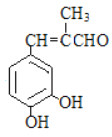
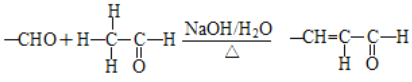题目内容
【题目】根据编号①~⑩代表的元素在周期表中的位置,回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | ② | ||||||
2 | ③ | ④ | ⑤ | ⑥ | ||||
3 | ⑦ | ⑧ | ⑨ | ⑩ |
(1)最高正价为+1价,还能显﹣1价的元素是____(填元素符号);⑦、⑧、⑨三种元素最高价氧化物对应的水化物,碱性由强到弱的顺序排列为________(填化学式).
(2)③的单质在空气中充分燃烧的化学方程式是________________________________.④与⑥形成的稳定化合物的电子式为______________.
(3)①、⑤、⑥三种元素形成的一种常见盐的化学式为________________,其中含有的化学键类型为_________________.
(4)高温灼烧由⑦与⑩形成的化合物时,火焰呈___色.⑤的最高价氧化物水化物的稀溶液与金属铜反应的离子方程式为______________________.
【答案】HNaOH>Mg(OH)2>Al(OH)34Li+O2![]() 2Li2O
2Li2O![]() NH4NO3离子键和共价键黄 3Cu+8H+ + 2NO3- === 3Cu2+ +2NO↑+4H2O
NH4NO3离子键和共价键黄 3Cu+8H+ + 2NO3- === 3Cu2+ +2NO↑+4H2O
【解析】
由元素在周期表的位置可以知道,①~⑩分别为H、He、Li、C、N、O、Na、Mg、Al、Cl,
(1)能显+1价,还能显-1价的元素位于IA族,金属无负价;金属性越强,对应高价氧化物对应的水化物的碱性越强;
(2)Li燃烧生成氧化锂;④与⑥形成的稳定化合物为二氧化碳;
(3)①、⑤、⑥三种元素形成的一种常见盐为硝酸铵;
(4)⑦与⑩形成的化合物为NaCl,焰色反应为元素的性质;稀硝酸与铜反应生成一氧化氮和硝酸铜。
(1)能显+1价,还能显-1价的元素位于IA族,金属无负价,则元素为H;金属性越强,对应高价氧化物对应的水化物的碱性越强,则⑦、⑧、⑨三种元素最高价氧化物对应的水化物分别为:NaOH、Mg(OH)2、Al(OH)3;所以碱性由强到弱的顺序排列为NaOH>Mg(OH)2>Al(OH)3 ;因此,本题正确答案是:H,NaOH>Mg(OH)2>Al(OH)3。
(2)Li燃烧生成氧化锂,方程式为4Li+O2![]() 2Li2O;④与⑥形成的稳定化合物为二氧化碳,为共价分子,碳氧原子间形成2对共用电子对,其电子式为
2Li2O;④与⑥形成的稳定化合物为二氧化碳,为共价分子,碳氧原子间形成2对共用电子对,其电子式为![]() ;因此本题答案是: 4Li+O2
;因此本题答案是: 4Li+O2![]() 2Li2O;
2Li2O; ![]() 。
。
(3)①、⑤、⑥三种元素形成的一种常见盐为硝酸铵,化学式为NH4NO3;它为离子化合物,含有离子键,同时氮原子与氢原子之间,氮原子和氧原子之间存在共价键;因此,本题答案是:NH4NO3,离子键和共价键。
(4)高温灼烧由⑦与⑩形成的化合物为NaCl,火焰呈黄色;⑤的最高价氧化物水化物的稀溶液为硝酸,与金属铜反应生成硝酸铜和一氧化氮,离子方程式为:3Cu+8H+ +2NO3- === 3Cu2+ +2NO↑+4H2O;综上所述,本题答案是:黄,3Cu+8H++2NO3- === 3Cu2++2NO↑+4H2O。