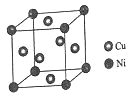
题目内容
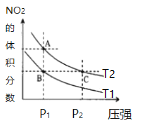
【题目】已知H2SO3HSO3-+H+,Ka1;HSO3-SO32-+H+,Ka2。常温下,向某浓度的H2SO3溶液中逐滴加入一定量浓度的NaOH溶液,所得溶液中H2SO3、HSO3-、SO32-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是( )
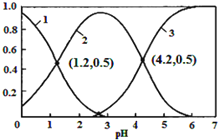
A.pH=1.2溶液中:c(Na+)+c(H+)=c(OH-)+c(H2SO3)
B.常温下,![]() =1000
=1000
C.向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离度先增大后减小
D.曲线3表示的微粒是SO32-
【答案】C
【解析】
![]() 溶液
溶液![]() 时,此时溶液中的亚硫酸根离子的浓度为0,
时,此时溶液中的亚硫酸根离子的浓度为0,![]() 、
、![]() 的含量相同浓度相同,而根据电荷守恒可知:
的含量相同浓度相同,而根据电荷守恒可知:![]() ,所以
,所以![]() ,选项A正确;
,选项A正确;
B.坐标![]() 时
时![]() 、
、![]() 的含量相同,则
的含量相同,则![]() ,坐标
,坐标![]() 时
时![]() 和
和![]() 的浓度相等,
的浓度相等,![]() ,常温下
,常温下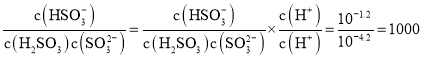 ,选项B正确;
,选项B正确;
C.向![]() 的溶液中加KOH溶液将pH增大至
的溶液中加KOH溶液将pH增大至![]() 的过程中,酸性减弱,水的电离被抑制程度减小,水的电离度先增大,选项C错误;
的过程中,酸性减弱,水的电离被抑制程度减小,水的电离度先增大,选项C错误;
D.由图象可知,溶液pH越大,3表示的离子的物质的量分数逐渐增大,则曲线3表示的是![]() ,选项D正确;
,选项D正确;
答案选C。

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
【题目】利用下图装置可以进行实验并能达到实验目的的是
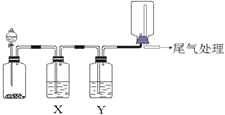
选项 | 实验目的 | X中试剂 | Y中试剂 |
A[] | 用MnO2和浓盐酸制取并收集纯净干燥的Cl2 | 饱和食盐水 | 浓硫酸 |
B | 用Cu与稀硝酸制取并收集纯净干燥的NO | 水 | 浓硫酸 |
C | 验证电石与饱和食盐水反应生成的气体的性质并收集 | CuSO4溶液 | KMnO4 |
D | CaCO3和稀盐酸制取并收集纯净干燥的CO2 | 饱和NaHCO3溶液 | 浓硫酸 |
A. A B. B C. C D. D