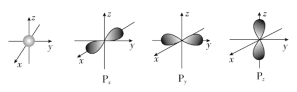
题目内容
【题目】反应N2O4(g) ![]() 2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法不正确的是
2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法不正确的是
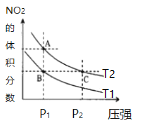
A.A点的反应速率小于C点的反应速率
B.A、C两点气体的颜色:A浅,C深
C.由状态B到状态A,可以用降温的方法
D.A、C两点气体的平均相对分子质量:A<C
【答案】C
【解析】
![]() ,该反应为吸热反应,升高温度,化学平衡正向移动,NO2的体积分数增大;增大压强,化学平衡逆向移动,NO2的体积分数减小,结合图象来分析解答。
,该反应为吸热反应,升高温度,化学平衡正向移动,NO2的体积分数增大;增大压强,化学平衡逆向移动,NO2的体积分数减小,结合图象来分析解答。
A. A、C两点都在等温线上,压强越大,反应速率越快;
B.增大压强平衡向逆反应进行,向逆反应进行是减小由于压强增大导致浓度增大趋势,但到达平衡仍比原平衡浓度大;
C.压强相同,升高温度,化学平衡正向移动,NO2的体积分数增大,A点NO2的体积分数大;
D. 增大压强,化学平衡逆向移动,C点时气体的物质的量小,混合气体的总质量不变,据此判断。
A. 由图象可知,A.C两点都在等温线上,C的压强大,则A.C两点的反应速率:A<C,故A正确;
B. 由图象可知,A、C两点都在等温线上,C的压强大,与A相比C点平衡向逆反应进行,向逆反应进行是由于减小体积增大压强,平衡移动的结果降低NO2浓度增大趋势,但到达平衡仍比原平衡浓度大,平衡时NO2浓度比A的浓度高,NO2为红棕色气体,则A.C两点气体的颜色:A浅,C深,故B正确;
C. 升高温度,化学平衡正向移动,NO2的体积分数增大,由图象可知,A点NO2的体积分数大,则T1<T2,由状态B到状态A,可以用加热的方法,故C错误;
D. 由图象可知,A.C两点都在等温线上,C的压强大,增大压强,化学平衡逆向移动,C点时气体的物质的量小,混合气体的总质量不变,则平均相对分子质量大,即平均相对分子质量:A<C,故D正确;
故答案选:C。

【题目】下列与新冠肺炎防疫和检测有关的过程中,没有发生化学反应的是( )
A | B | C | D |
|
|
|
|
以丙烯为原料制备熔喷聚丙烯,作为医用外科口罩的材料 | 电解饱和食盐水制备消毒液,对公共场所进行消毒 | 使用明矾作为絮凝剂,对采集水样进行前处理 | 使用液氨作为制冷剂, 对疫苗进行低温保存 |
A.AB.BC.CD.D