题目内容
11.以粗硅(含铁、铝等杂质)为原料工业上有以下两种制备高纯硅的工艺.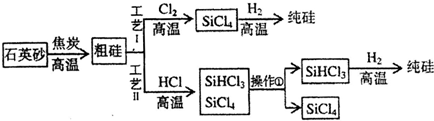
已知:SiCl4沸点57.5℃,遇水强烈水解:SiHCl3沸点31.5℃,且能与H2O强烈反应,并在空气中易自燃,300℃时FeCl3、AlCl3均能升华.
(1)为鉴定粗硅中含有微量铁单质,将试样研磨后用稀盐酸溶解,并取上层清液加入下列试剂中的bd(填字母).
a.碘水 b.氯水 c.Na2SO3溶液 d.KSCN溶液
常温下SiHCl3和SiCl4均为液体,上述流程中操作①为蒸馏.
(2)实验室用如图1装置制备SiCl4(反应温度在400℃~500℃).
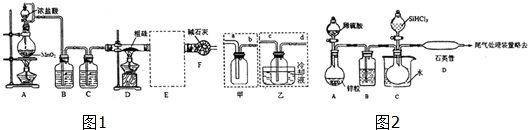
①装置F的作用是吸收尾气Cl2,并防止空气中的水蒸气进入广口瓶.实验开始应先点燃A(填”A“或”D“)装置的酒精灯一段时间后再点燃另一酒精灯.
②E处收集装置设计了甲、乙两套装置,请你分别指出两套装置的不足之处甲方案未用冷却液冷却易损失SiCl4,乙方案进气管c太细易堵塞.为使甲装置易于收集产物,则需对装置进行的改进为甲方案中的广口瓶浸入盛有冷却液的水槽中(用文字表达).
(3)SiHCl3与过量H2制备纯硅的装置如图2(热源及夹持装置已略去).
装置B中的试剂是浓硫酸(填名称),装置C中的烧瓶需要加热,其目的是使进入烧瓶的液态SiHCl3变为气体.实验中先让稀硫酸与锌粒反应一段时间后,再加热C、D装置的理由是让H2排尽装置中的空气,防止SiHCl3水解和自燃,装置D中发生反应的化学方程式为SiHCl3+H2$\frac{\underline{\;高温\;}}{\;}$Si+3HCl.
分析 (1)由于Fe与盐酸反应生成氯化亚铁,再滴入KSCN、氯水,溶液变红色,说明粗硅中含有铁单质;
常温下SiHCl3和SiCl4均为液体,二者互溶,沸点相差较大,采取蒸馏法进行分离;
(2)利用图1装置制备SiCl4,SiCl4遇水强烈水解,制备装置应干燥,A装置制备氯气,B装置吃饭饱和食盐水,吸收氯气中的HCl,C装置充分浓硫酸,干燥氯气,氯气与Si在D装置中反应生成SiCl4,SiCl4沸点57.5℃,反应得到SiCl4蒸汽,应进行冷却收集,未反应的氯气需要用氢氧化钠溶液吸收,防止污染空气,由于SiCl4遇水强烈水解,F装置可以吸收尾气Cl2,并防止空气中的水蒸气进入广口瓶.
①实验开始应先制备氯气,并用氯气排尽装置中的空气,再进行合成SiCl4的反应;
②甲方案未用冷却液冷却易损失SiCl4,乙方案进气管c太细易堵塞,将甲方案中的广口瓶浸入盛有冷却液的水槽中;
(3)图2中,A装置制备氢气,B装置中盛放浓硫酸,干燥氢气,防止SiHCl3与水反应,装置C中的烧瓶需要加热,使进入烧瓶的液态SiHCl3变为气体,实验中应先通入一定时间H2排尽装置中的空气,防止SiHCl3水解和自燃,在D装置中发生置换反应得到Si与HCl.
解答 解:(1)由于Fe与盐酸反应生成氯化亚铁,再滴入KSCN溶液与氯水,溶液变红色,说明粗硅中含有铁单质;
常温下SiHCl3和SiCl4均为液体,二者互溶,沸点相差较大,采取蒸馏法进行分离,
故答案为:bd;蒸馏;
(2)利用图1装置制备SiCl4,SiCl4遇水强烈水解,制备装置应干燥,A装置制备氯气,B装置吃饭饱和食盐水,吸收氯气中的HCl,C装置充分浓硫酸,干燥氯气,氯气与Si在D装置中反应生成SiCl4,SiCl4沸点57.5℃,反应得到SiCl4蒸汽,应进行冷却收集,未反应的氯气需要用氢氧化钠溶液吸收,防止污染空气,由于SiCl4遇水强烈水解,F装置可以吸收尾气Cl2,并防止空气中的水蒸气进入广口瓶.
①F装置的作用是:吸收尾气Cl2,并防止空气中的水蒸气进入广口瓶;实验开始应先制备氯气,并用氯气排尽装置中的空气,防止SiCl4水解,再进行合成SiCl4的反应,实验开始应先点燃A处酒精灯,
故答案为:吸收尾气Cl2,并防止空气中的水蒸气进入广口瓶;A;
②甲方案未用冷却液冷却易损失SiCl4,乙方案进气管c太细易堵塞,为使甲装置易于收集产物,将甲方案中的广口瓶浸入盛有冷却液的水槽中,
故答案为:甲方案未用冷却液冷却易损失SiCl4,乙方案进气管c太细易堵塞;甲方案中的广口瓶浸入盛有冷却液的水槽中;
(3)图2中,A装置制备氢气,B装置中盛放浓硫酸,干燥氢气,防止SiHCl3与水反应,装置C中的烧瓶需要加热,使进入烧瓶的液态SiHCl3变为气体,实验中应先通入一定时间H2排尽装置中的空气,防止SiHCl3水解和自燃,在D装置中发生置换反应得到Si与HCl,反应方程式为:SiHCl3+H2$\frac{\underline{\;高温\;}}{\;}$Si+3HCl,
故答案为:浓硫酸;使进入烧瓶的液态SiHCl3变为气体;让H2排尽装置中的空气,防止SiHCl3水解和自燃;SiHCl3+H2$\frac{\underline{\;高温\;}}{\;}$Si+3HCl.
点评 本题考查制备实验方案的设计,综合了氯气的制法、硅的提纯、物质的分离提纯、对装置与操作的分析评价等实验知识,结合物质的性质明确原理为解答的关键,题目难度中等.

 同步练习强化拓展系列答案
同步练习强化拓展系列答案①S(单斜,s)+O2(g)=SO2(g)△H1=-297.16kJ•mol-1
②S(正交,s)+O2(g)=SO2(g)△H2=-296.83kJ•mol-1
③S(单斜,s)=S(正交,s)△H3( )
| A. | △H3=0.33 kJ•mol-1 | |
| B. | 单斜硫转化为正交硫的反应是吸热反应 | |
| C. | 正交硫比单斜硫稳定 | |
| D. | 单斜硫比正交硫稳定 |
| 分子式 | 外观 | 热分解温度 | 熔点 | 溶解性 |
| CO(NH2)2•H2O2 | 白色晶体 | 45℃ | 75-85℃ | 易溶于水、有机溶剂 |

请回答下列问题:
(1)反应器的加热方式是水浴加热;反应温度需控制在适当温度下进行,温度不能过高的原因是温度过高,产品易分解,致使活性氧含量降低,温度也不能过低的原因是温度过低,反应速率太慢,且反应体系制冷需要消耗大量能量.
(2)若欲从母液中分离出H2O2和尿素,可采用的操作是减压蒸馏、结晶.
(3)干法工艺制取过氧化尿素的方法是:采用高浓度双氧水水溶液喷雾到无水尿素固体上进行反应,水和反应热通过流态床移去而得到干燥的过氧化尿素产品.
比较干法与湿法两种工艺,你认为干法工艺的优点是:流程短,工艺简单(答出一点即可),干法工艺的缺点是:双氧水浓度高经济效益低,设备复杂等(答出两点即可),湿法工艺的优点是:低浓度双氧水,经济效益高,设备简单易于达到,母液可循环使用等(答出两点即可).
(4)准确称取0.6000g产品于250mL锥形瓶中,加适量蒸馏水溶解,再加1mL 6mol•L-1H2SO4,用0.1000mol•L-1KMnO4标准溶液滴定至终点时消耗20.00mL(尿素与KMnO4溶液不反应),则产品中CO(NH2)2•H2O2的质量分数为78.3%(结果保留到小数点后一位).
| A. | $\frac{1000Vρ}{22400+36.5V}$ mol/L | B. | $\frac{Vρ}{22400}$ mol/L | ||
| C. | $\frac{Vρ}{22400+36.5}$ mol/L | D. | $\frac{V}{22.4}$ mol/L |
| 选项 | 性质 | 应用 |
| A | 油脂在一定条件下能发生水解反应 | 油脂在碱性条件下水解制肥皂 |
| B | 硫酸铵等盐类 能使蛋白质变性 | 可用硫酸铵作杀菌消毒剂 |
| C | 糖类都能发生水解反应 | 可用淀粉、纤维素水解制葡萄糖 |
| D | 明矾溶于水可发生水解反应 | 明矾可用于自来水的净化、杀菌消毒 |
| A. | A | B. | B | C. | C | D. | D |
 天然维生素P(结构如图,)存在于槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述错误的是( )
天然维生素P(结构如图,)存在于槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述错误的是( )| A. | 1mol该有机物一定条件下可以和5mol溴水反应 | |
| B. | 该有机物的分子式为C15H8O7R | |
| C. | 1mol该有机物一定条件下最多消耗8 mol H2 | |
| D. | 1mol维生素P可以和4molNaOH反应 |
| A. | Na2CO3溶液 | B. | Na[Al(OH)4]溶液 | C. | NaHCO3溶液 | D. | NaHSO3溶液 |
| A. | 锌为正极,空气进入负极反应 | B. | 负极反应为Zn-2e-═Zn2+ | ||
| C. | 正极上发生氧化反应 | D. | 电解液可以是酸或碱溶液 |
 最常见的塑化剂邻苯二甲酸二丁酯可由邻苯二甲酸酐与正丁醇在浓硫酸共热下反应制得,反应的化学方程式及装置图(部分装置省略)如图:
最常见的塑化剂邻苯二甲酸二丁酯可由邻苯二甲酸酐与正丁醇在浓硫酸共热下反应制得,反应的化学方程式及装置图(部分装置省略)如图: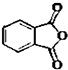 +C4H9OH$\stackrel{H_{2}SO_{4}}{→}$
+C4H9OH$\stackrel{H_{2}SO_{4}}{→}$ 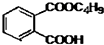 $→_{C_{4}H_{9}OH}^{H_{2}SO_{4}}$
$→_{C_{4}H_{9}OH}^{H_{2}SO_{4}}$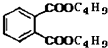
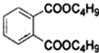 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$ +2CH3CH2CH2CH2OH.
+2CH3CH2CH2CH2OH.